第四部:無機化学の基礎 金属元素(典型元素)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,周期表 1族の金属元素について, 【アルカリ金属とは】, 【物性について】, 【アルカリ金属の軟らかさと軽さ】, 【参考:天然での存在,モース硬度,ミネラル】 に項目を分けて紹介する。
アルカリ金属とは
アルカリ金属元素とは,金属の化学的性質による分類で紹介したように,周期表 1 族の水素( H )を除くリチウム( Li ),ナトリウム( Na ),カリウム( K ),ルビジウム( Rb ),セシウム( Cs ),フランシウム( Fr )の総称である。
一般的には,フランシウム( Fr )の存在量が極めて少なく,安定同位体が存在せず半減期が極めて短いため,これを除くLi , Na , K , Rb , Cs をアルカリ金属元素と称する場合が多い。
なお,太字の元素は,レアメタルに,青字は必須ミネラルに分類される元素である。
周期表 1 族の元素は,S 軌道に電子を 1 個持つ。水素とアルカリ金属元素の違いは,電子配置の閉殻構造の有無に起因する。アルカリ金属元素の場合は,S 軌道の電子を失い,1 価の陽イオンとなることで,原子番号が一つ小さいハロゲン元素と同じ閉殻構造になり非常に安定化する。一方で,水素の陽イオンは,プロトンむき出しの正電荷となり,電子を核から引き放なす為のイオン化エネルギーが非常に大きい。
この S 軌道電子の振る舞いの違いが,水素には共有化合物としての性質を与え,アルカリ金属元素に金属としての性質を与えている。
アルカリ金属元素の単体は,全て軟らかく,軽い金属である。また,陽性が強く(電気陰性度が小さい,イオン化傾向が大きい),1 価の陽イオンになり易いため,常温で水との接触で水素を発生しながら激しく反応するのみならず,常温の空気中で酸素と速やかに反応する。このため,Li , Na , K 単体の保管では,空気・水蒸気との接触を防止できる石油などに浸漬するのが一般的である。
水との反応: 2M + 2H2O → 2MOH ( M+ + OH- ) + H2↑
酸素との反応: 4M + O2 → 2M2O
アルカリ金属元素は,他の元素との電気陰性度の差が大きい,このため,多くの化合物は,イオン結合性が大きく,水に容易に溶ける塩化物,硫酸塩,硝酸塩,炭酸塩,酢酸塩などの塩を形成する。
アルカリ金属元素の水酸化物は,水溶液中で強い塩基性を示す。塩基性は,アルカリ性ともいい,これが,アルカリ金属元素の名前の由来でもある。
アルカリ金属元素は,特徴のある炎色反応を示すことで知られている。
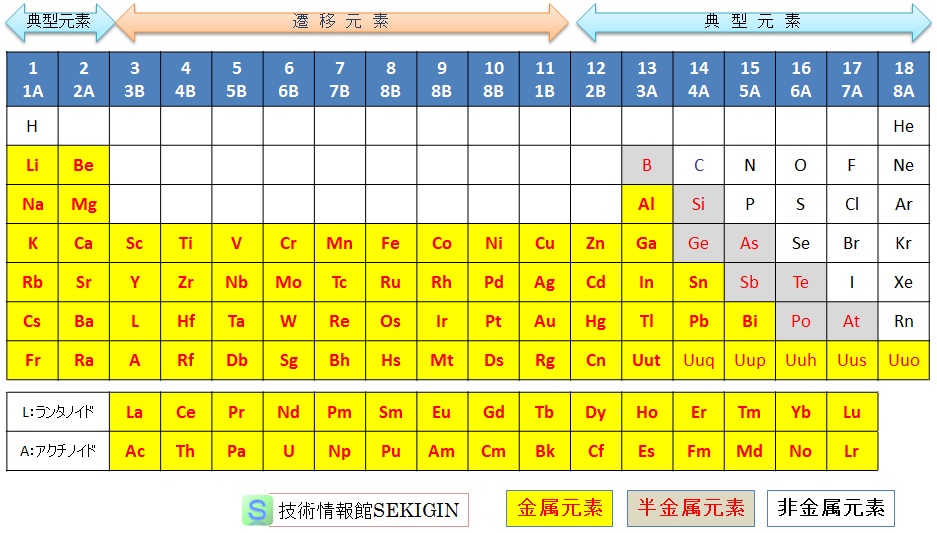
周期表(2015年)
ページの先頭へ
物性について
ポーリングの電気陰性度,イオン化エネルギーは別途紹介している。なお,これらの値は,算出に用いる解離エネルギー値や結合エネルギー値の改訂で変わるので,紹介した値は最新値ではなく,引用文献での値である。
次にアルカリ金属元素(単体)の基礎物性を紹介する。なお,比較のため,身近な金属単体として,アルミニウム(Al),鉄(Fe),銅(Cu)の値も併記する。
| 元素記号 | Li | Na | K | Rb | Cs | Al | Fe | Cu |
|---|---|---|---|---|---|---|---|---|
| 原子番号 | 3 | 11 | 19 | 37 | 55 | 13 | 26 | 29 |
| 原子量 | 6.94 | 22.99 | 39.10 | 83.47 | 132.9 | 26.98 | 55.85 | 63.55 |
| 融点(℃) | 180.5 | 97.7 | 63.4 | 38.3 | 28.4 | 660.3 | 1538 | 1084 |
| 密度(×106 gm-3) | 0.534 | 0.968 | 0.86 | 1.53 | 1.93 | 2.70 | 7.87 | 8.94 |
| 結晶構造 | bcc | bcc | bcc | bcc | bcc | fcc | bcc | fcc |
| 格子定数(×10-10 m) | 3.509 | 4.291 | 5.247 | 5.605 | 6.067 | 4.0496 | 2.867 | 3.615 |
| モース硬度 | 0.6 | 0.5 | 0.4 | 0.3 | 0.2 | 2.8 | 4.0 | 3.0 |
| 電気抵抗(×10-8 Ωm:20℃) | 9.28 | 4.77 | 7.2 | 12.8 | 20.5 | 2.82 | 9.61 | 1.68 |
| 熱伝導率( W m-1K-1:300K) | 84.8 | 142 | 103 | 58.2 | 35.9 | 237 | 80.4 | 401 |
備考: fcc (立方最密充填,面心立方格子),bcc (体心立方格子)
ページの先頭へ
アルカリ金属の軟らかさと軽さ
単体が柔らかいとは?
固体の硬さについては,【塗膜の硬さ】で紹介したように,物体表面の変形のしにくさを評価する「押込み硬さ」,物体表面の傷つきにくさを評価する「引っかき硬さ」に大別される。
モース硬度は,硬度比較の標準鉱物を用いて「引っかいた時の傷の付きにくさ」の相対比較で評価される硬さである。従って,モース硬度は変形し易さや靭性とは異なる特性を評価していることになる。
アルカリ金属のモース硬度は,表に示すように,軟らかい金属として知られるアルミニウムに比較しても著しく小さい。この原因として金属結合エネルギーの大きさが考えられる。
アルカリ金属のモース硬度は,表に示すように,軟らかい金属として知られるアルミニウムに比較しても著しく小さい。この原因として金属結合エネルギーの大きさが考えられる。
金属結合の結合エネルギーは,自由電子に関与する電子の範囲で大きく異なる。汎用の金属では,バンド理論で説明されるように,内殻電子も金属結合に関与している。例えば,硬い金属とされるタングステンは,結合エネルギーが 850 kJ /mol に達する。
一方,アルカリ金属では,閉殻電子は自由電子に関与せず,最外殻電子(価電子)が金属結合に関与しているのみであり,結合エネルギーは 80 ~ 160 kJ /mol 程度と小さい。
単体が軽いとは?
軽いとは,単体の密度が著しく小さいことを意味する。例えば,軽金属の代表ともいえるアルミニウム( Al )は,原子量 27 ,単体の密度 2.70×106 g m-3 であるのに対し,ナトリウム( Na )の原子量 23 ,単体の密度 0.968×106 g m-3 である。両金属の原子量の比 Al / Na ≒ 1.17に対し,密度の比は,Al / Na ≒ 2.79 と,アルカリ金属単体の密度は,アルミニウムとの原子量の差異に比較して著しく小さいといえる。この差は,金属単体の原子の大きさと結晶構造の違いの影響と考えられる。
原子の大きさは,【イオンサイズ】で紹介した共有結合半径で比較すると,アルミニウムの 125 pm(ピコメートル)に対し,ナトリウムは157 pm と大きい。
結晶構造は,表に示すようにアルカリ金属の単体は,全て bcc (体心立方格子)に対し,アルミニウム単体は表で紹介したように,最密充填構造である fcc (立方最密充填,面心立方格子)である。
ここで,ナトリウム単体と同じ体心立方格子の鉄( Fe )と比較してみる。格子定数の比 Na:Fe = 4.291:2.867 から体積の比を求めると Na/Fe = 3.353 となり,原子量の比 Fe/Na = 2.439 と Na の密度 0.968×106 g m-3 で鉄単体の密度を求めると,密度 7.874×106 g m-3 となる。
ページの先頭へ
参考
天然での存在と産出
リチウムは,ペタル石( LiAlSi4O10 ),リチア雲母( K (Li,Al)3 (AlSi3O10) (OH,F)2 ),リチア輝石( LiAlSi2O6 )などの鉱石鉱物として採掘される。また,海水中にも約 0.18 ppm 含まれる。
ナトリウムは,海水の成分として,岩塩( NaCl )として産出される。
カリウムは,植物に不可欠の成分で,炭酸カリウム( K2CO3 )として木灰に含まれる。カリウムを含む天然鉱物には,黒雲母( K2 (Mg,Fe,Al)6-5 (Si,Al)8 O20 (OH)4 ),リチア雲母( K (Li,Al)3 (AlSi3O10) (OH,F)2 )がある。
ルビジウムは,主成分とする鉱物はなく,リチウムやセシウムを精製する際の副産物として得られる。
セシウムは,天然の鉱石にポルックス石( CsAlSi2O6 )が存在する。工業的にはリチウムを精製する際の副産物として得られる。
モース硬度(Mohs hardness)
モース硬さやモース硬さスケール( Mohs' scale of hardness )とも言われ,ドイツの鉱物学者フリードリッヒ・モースが考案した硬さの尺度の一つである。
モース硬度の標準鉱物として,滑石(モース硬度 1 ),方解石(モース硬度 3 ),石英(モース硬度 7 ),ダイヤモンド(モース硬度 10 )などの 10 種の鉱物が指定されている。
なお,モース硬度の身近な例には,人間の爪( 2.5 ),十円硬貨( 3.5 ),ガラス( 5 ),やすり( 7.5 )がある。
必須ミネラル
健康増進法(平成 14年法律第 103 号)に基づき厚生労働大臣が定める「日本人の食事摂取基準(2015年版)」 に基準摂取量が定められているミネラルをいう。必要所要量の違いで,主要ミネラル 7 種,微量ミネラル 9 種に分けられる。
主要ミネラル( 100 mg /1日 以上):硫黄 S(骨・軟骨・皮膚・髪の毛・爪など),塩素 Cl(胃液中の胃酸),ナトリウム Na(血液・体液の浸透圧を調整),カリウム K( 血圧の上昇抑制,利尿作用),マグネシウム Mg(骨や歯の強か,酵素の補助),カルシウム Ca(骨・歯の成分,エネルギー代謝),リン P(骨・歯の成分,代謝の補助)
微量ミネラル( 100 mg /1日 未満): 鉄 Fe(赤血球のヘモグロビン),亜鉛 Zn(生殖機能,ホルモン合成),銅 Cu(ヘモグロビン生成,骨格成分),マンガン Mn(骨や関節),ヨウ素 I(甲状腺ホルモン,代謝),セレン Se(抗酸化力,老化防止),モリブデン Mo(肝臓,腎臓の老廃物分解),クロム Cr(糖の代謝),フッ素 F(虫歯予防)
ページの先頭へ