第一部:化学と物質構造・イオン結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
イオンとは
単原子,又は原子団(複数の原子が結合)は,最外殻の軌道電子を放出することで正の電荷を持つ陽イオンに,最外殻の電子軌道に電子を受け取ることで負の電荷を持つ陰イオンになる。
どのような過程を経てイオンになるかを,周期表第 1 族(アルカリ金属元素)のナトリウム( Na )に,第 17 族(ハロゲン元素)の塩素( Cl )が接近した場合で考えてみる。
【原子の構造】で紹介したように,ナトリウムの電子配置は,1s2 2s2 2p6 3s1 と K 殻と L 殻の軌道が電子で満たされ,最外殻の M殻の s 軌道に電子が 1個存在する。この電子を排出することで,安定な希ガス元素のネオン( Ne )と同じ電子配置( 1s2 2s2 2p6 )になることができる。
塩素の電子配置は,1s2 2s2 2p6 3s2 3p5 と K 殻と L 殻の軌道が電子で満たされ,最外殻の M殻の s 軌道と p軌道に電子が 7個存在する。M 殻の軌道に電子を1個受け取ることで,安定な希ガス元素のアルゴン( Ar )と同じ電子配置( 1s2 2s2 2p6 3s2 3p6 )になる。
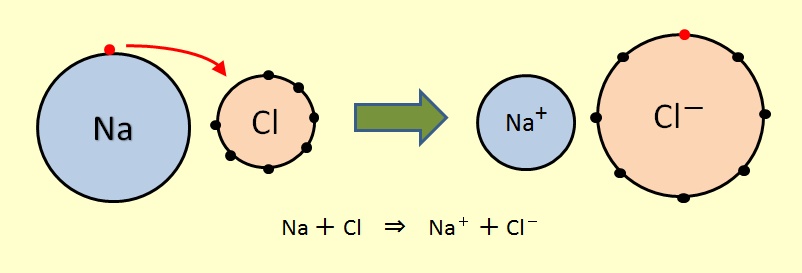
イオンの生成
また,ナトリウム元素の低い第一イオン化エネルギー,塩素元素の高い電子親和力のため,陽イオンのナトリウムイオン,陰イオンの塩化物イオンともイオンとして安定して存在できる。
【参考】
電気陰性度( electronegativity )
化学結合にあずかる電子(共有電子対)を引き寄せる力の強弱を表す尺度である。一般的には,電気陰性度の小さい元素は,陽性が強く(陽イオンになり易い),大きい元素は,陰性が強い(陰イオンになり易い)と考えてよい。
電気陰性度の尺度を決める方法が種々提案されている。 この中で,広く用いられているのは,二原子分子の解離エネルギー,共有結合エネルギー,イオン結合エネルギーなどから求めたポーリング提案の値である。
イオン化エネルギー( ionization energy )
気体状態の単原子(又は基底状態の分子)から原子やイオンなどから電子を取り去るのに要するエネルギー,すなわち,取りだされた電子の結びつきの強さの目安で,エネルギーが小さいほど陽イオンになり易く,陽性が強いという。
電子を 1個引き抜くのに必要なエネルギーを第一イオン化エネルギーといい,電子を 1個失った状態からさらに 1個引き抜くときのエネルギーを第二イオン化エネルギーという。
電子親和力( electron affinity )
電子親和力は,1個の原子(又は分子)に電子を付加する際に放出するエネルギーである。放出するエネルギーが大きいほど電子を受けとった状態(陰イオン)が安定であることを意味する。
エネルギーがマイナスの場合は,電子を受け取るためにエネルギーが必要であることを意味し,陰イオンになり難いことを意味する。
ページの先頭へ