第二部:物質の状態と変化 熱運動と状態変化
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,物質状態の理解の基本として,【物質の状態とは】, 【温度について】, 【密度について】, 【水の三重点】 に項目を分けて紹介する。
物質の状態とは
物質の状態,固体,液体,気体をまとめて物質の三態( three states of matter )や三相( three phases of matter )と呼ぶ。三態が安定的に共存する温度を三重点( triple point )という。
なお,物質の状態を分類する場合に,古典的な固体,液体,気体に加えて,気体状態のイオン,即ちプラズマ( plasma )を含める場合もある。
ここでは,三態(固体,液体,気体)の概要,広く用いられる 3種の温度( K ,℃, ℉ ),及び温度校正などに用いられる水の三重点の実現方法を紹介する。
三態について
固体( solid )
固体は,物質の三態の一つで,液体と比較して変形や体積変化が極めて小さい。固体を構成する粒子(原子,分子やイオン)は,粒子間の相互作用(引力)により粒子の移動が制限される。粒子が規則正しい繰り返しで並ぶ場合(結晶)と不規則に並ぶ場合(アモルファス)がある。
液体( liquid )
液体は,物質の三態の一つで,流動的で容器に合わせて形を変えることができる。液体は気体と異なり,粒子間の相互作用(引力)で粒子間の距離がほぼ一定に保たれ,容器全体に広がることが無い。また,圧縮性が小さいので,ほぼ一定の密度を保つ。一般的に,液体の密度は,固体の密度に近く,気体より著しく高い。液体特有の性質として表面張力があり,これによって「濡れ現象」が起きる。
気体( gas )
気体は,物質の三態の一つで,一定の形と体積を持たず,自由に流動し,圧縮やずれに対する抵抗が小さく,圧力の増減で体積が容易に変化する状態である。また,外部から力を受けない状態では,気体の体積が無限に膨張する。
気体を構成する粒子(原子や分子)は,自由かつランダムに動く熱運動をしている。気体の粒子は,それぞれ離れているため,粒子間には引力(分子間力)が働かない。
1 種類の気体分子で構成される純粋な気体には,ヘリウムやネオンのような単原子分子(希ガス元素),酸素や窒素などの等核原子分子,二酸化炭素などの複数の元素の原子から成る化合物がある。混合気体とは,空気のように,2 種以上の気体分子の混合物をいう。
ページのトップへ
温度について
歴史的には定義の違う多くの温度が存在していた。現在は,熱力学的温度(ケルビン K ,絶対温度ともいう),セルシウス度( ℃,摂氏ともいう)が,技術分野,日常生活で広く用いられている。なお,米国では,気象情報などの日常でファーレンハイト度( ℉ ,華氏ともいう)がいまだに用いられている。
熱力学的温度 K ( thermodynamic temperature)
一般的には絶対温度と呼ばれることが多い。熱力学的温度は,1848 年にウィリアム・トムソン(イギリスの物理学者,初代ケルビン男爵)のカルノーサイクル(温度の異なる 2 つの熱源の間で動作する可逆熱サイクル)で出入りする熱エネルギーから温度目盛を構築できることを提唱し,カルノーサイクルの効率が 1 となる温度(これ以上冷やせない温度)を基準( 0 K ,-273.15 ℃)とした。
この基準の温度に到達するには無限の仕事が必要となるので,この温度を絶対零度( 0 K )という。温度の単位は,ウィリアム・トムソンの爵位からケルビン( K )を用いる。温度目盛の間隔は,セルシウス度と同じ,即ち 1 K = 1 ℃である。
現在は,物質量の比により厳密に定義(国際度量衡委員会)された同位体組成を持つ水の三重点( triple point )の熱力学温度の 1/273.16 を 1 ケルビン( K )と定義している。
セルシウス度 ℃ ( degree Celsius )
アンデルス・セルシウス(スウェーデンの天文学者)が 1742 年に考案したものに基づいている。彼は,1気圧での水の沸点を 0℃,凝固点を 100℃と現在とは逆に定義していたが,セルシウス死後の 1744 年に,水の凝固点を 0℃,沸点を 100℃に改められた。
現在のセルシウス度は,ケルビンを元に定義され,水の三重点の値を 273.16 K としている。従って,歴史的な定義であった標準大気圧の下での水の沸点と氷点は,厳密には 100℃,0℃ではない。
ファーレンハイト度 ℉ (degree Fahrenheit)
ガブリエル・ファーレンハイト(ドイツの物理学者)が 1724 年に提唱したもので,ファーレンハイト温度目盛は,水の融点を 32 ℉,沸点を 212 ℉ とし,氷点と沸点の間を 180度で区切られる。この温度は,人間の温度感覚(極寒の冬 0 ℉ = -17.8℃,欧米人の体温 100 ℉ = 37.8℃)に符合するので,米国では現在も天気予報などで日常的に用いられている。
セルシウス度(℃)とは次の関係にある。
℃ = 5 ( ℉ - 32 ) / 9
ページのトップへ
密度について
密度( density )
3次元(空間),2次元(面),1次元(線)に分布するある量の割合を密度という。単に密度といえば,一般的には単位体積あたりの質量を指す質量密度をいう。
3次元の密度,すなわち体積密度には,単位体積あたりの物質の量を指す質量密度,物質の数を指す数密度,単位体積中の電荷(電子,原子核,イオン)の量を指す電荷密度などがある。
2次元の密度には,単位面積当たりの人の数を表す人口密度,単位面積あたりの磁束を指す磁束密度(磁場),単位面積に垂直な方向に単位時間に流れる電気量(電荷)を指す電流密度,記録メディアにおける単位面積あたりの記録容量を指す記録密度などがある。
工学的には,物質の量の割合を対象物の面状の分布や線状の分布で表すため,単位面積あたりの面密度や単位長さあたりの線密度で表すことがある。
密度の単位
単位体積の物質の質量を意味する質量密度の単位は,国際単位系( International System of Units ,略称 SI )では,kg/m3 (キログラム毎立方メートル)の使用を推奨し,日本の計量法では,kg/m3 ,g/m3 ,g/L の 3つが定められている。過去には,g/cm3 が多く用いられていた。
参考: 103 kg/m3 = 1 g/cm3 , 1 kg/m3 = 1 g/L
基準とした物質( 4℃の水,0℃ 1気圧の空気など)の密度との比を意味する比重(無次元量)と似た数値のため混同されがちであるが,比重には単位がなく,密度とは定義が異なるので注意が必要である。
密度・比重の測定法
JIS Z 8807「固体の密度及び比重の測定方法」
適用範囲
この規格は,比重瓶,ルシャテリエ比重瓶,液中ひょう量法,幾何学的測定による方法,音響法,気体置換法を用いた固体の密度及び比重の測定方法,並びにこれらの測定において計量計測トレーサビリティを確保する方法について規定する。
3 用語及び定義
3.1 密度(density): 試料固体の単位体積当たりの質量。
3.2 比重(specific gravity): 試料固体の密度を,圧力101 325 Paの下における水の密度で除したもの。温度 t℃における試料固体の密度を温度 t0℃の水の密度で除した場合は,比重 t/t0℃,と表記する。
注記 比重 t/t0℃を比重 t/4℃に換算する場合は,比重 t/t0℃に温度 t0℃の水の比重 t0/4℃を乗じる。
目次
6 比重瓶による密度及び比重の測定方法,7 ルシャテリエ比重瓶による密度及び比重の測定方法,8 液中ひょう量法による密度及び比重の測定方法,9 幾何学的測定による密度及び比重の測定方法,10 音響法による密度及び比重の測定方法,11 気体置換法による密度及び比重の測定方法
JIS Z 8837「体積置換による密度の測定− ガスピクノメータ法による骨格密度」
適用範囲
規則形状又は不規則形状で,粉末状又は一つの塊状となった固体試料の骨格密度を,ガスピクノメータを用いて迅速かつ効率的に測定する方法について規定する。
3 用語及び定義
3.1 密度(density): 所定の試料質量とその物質が占有する体積との比。
3.2 固体真密度(true solid state density): 試料質量と空隙を含まない骨格体積との比。この“空隙を含まない骨格体積”とは,開気孔(open pore)及び閉気孔(closed pore)又は内部空隙,並びに造粒された又は微粒子化された試料における粒子間空隙を除いた体積をいう。
3.3 骨格密度(skeleton density): 試料質量と,閉気孔(もし存在するならば)の体積を含み,開気孔及びバルク試料内の粒子間空隙を除いた試料体積との比。
3.4 閉気孔(closed pore): 壁によって完全に閉ざされ,他の細孔と相互に連結せず,流体が侵入できない細孔。
3.5 開気孔(open pore): 壁によって完全に閉ざされることなく,直接的に又は他の細孔と連結して粒子表面に開かれ,流体が侵入できる細孔。
5 原理
骨格密度は,膨張型のガスピクノメータ(以下,ガスピクノメータという。)を用いた体積測定によって求める。この方法は,固体の体積をガスの体積に置換することに基づく。測定は,一定温度に保たれている室(例えば,試料室)に充塡されているガスを,別の室(例えば,参照室)に等温膨張させることによって行う。
固体の質量密度の種類
真密度:物質の真実の状態の密度。物体の表面や内部の気孔の部分を除いた物体そのものの体積で物体の質量を割った値。
見かけ密度:物体の表面の気孔の体積は除くが,内部の気孔の体積を含めて求めた密度。
嵩密度:粉体を容器内に詰め,容器内の隙間も体積と見なして測定した密度(この場合は見かけ密度ともいう)。
タップ密度:粉体を容器に詰める際に振動させてより充填させて測定した嵩密度。
一般に 真密度 ≧ 見かけ密度 ≧ 嵩密度
JIS Z 8804「液体の密度及び比重の測定方法」
適用範囲
比重瓶,浮ひょう,振動式密度計,磁気浮上式密度計及び液中ひょう量法を用いた液体の密度及び比重の測定方法,並びにこれらの測定において計量計測トレーサビリティを確保する方法について規定する。
3 用語及び定義
3.1 密度(density): 試料液体の単位体積当たりの質量。
3.2 比重(specific gravity): 試料液体の密度を,圧力101 325 Paの下における水の密度で除したもの。温度 t℃における試料液体の密度を温度 t0℃の水の密度で除した場合は,比重 t/t0℃,と表記する。
注記 比重 t/t0℃を比重 t/4℃に換算する場合は,比重 t/t0℃に温度 t0℃の水の比重 t0/4℃を乗じる。
目次
6 比重瓶による密度及び比重の測定方法,7 液中ひょう量法による密度及び比重の測定方法,8 浮ひょうによる密度及び比重の測定方法,9 振動式密度計による密度及び比重の測定方法,10 磁気浮上式密度計による密度及び比重の測定方法
気体の密度
気体は,アボガドロの法則に従う。すなわち,温度,圧力が一定ならば,どの種類の気体でも同体積中に同数の分子が含まれるので,気体の密度を比べるときは分子 1個あたりの質量で比べることができる。
従って,気体の密度は,原理的には,理想気体に近い気体に関しては,気体の状態方程式( ideal gas law )により算出できる。
より的確に推算するためには,実在気体について適用されるファンデルワールスの状態方程式( van der Waals equation ) やレドリッヒ=クオンの状態方程式( Redlich–Kwong equation )を用いて推算できる。
気体は温度,圧力の影響により体積が変化するため気体の標準状態( NTP ),すなわち大気圧 101.325 kPa,気温 0 ℃の下に保持された状態の密度を添え字(ntp)をつけて kg/m3(ntp)で表す。標準状態以外の状態での密度は,指定された状態(操業状態,オペレーション状態)での密度を意味する添え字(op)を付けた kg/m3(op)で表す。
ページのトップへ
水の三重点
温度計の校正などに用いる水の三重点( 0.01℃, 610Pa )の実現には,図に示すような石英ガラス製のセルを用いる。
このセルは,中央に温度計を差し込めるガラス管を有し,内部を真空排気した後で,規定された同位体組成の水を封入したものである。従って,内部の空隙は規定の水の蒸気で満たされている。
三重点の状態は,温度計を差し込むガラス管に寒剤(ドライアイスなど)を入れ,中央のガラス管周辺に適度の厚さの氷の膜を作ることで実現できる。
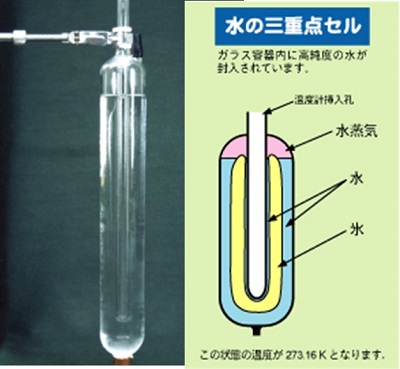
水の三重点の実現
写真出典:(独法)産総研 計量標準管理センター
https://www.nmij.jp/library/units/temperature/
ページの先頭へ