第四部:無機化学の基礎 無機化学とは(基本)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,無機化合物の光学特性に関連し, 【X線の吸収と発生】,【特性X線発生原理】,【主な元素の特性X線例】に項目を分けて紹介する。
X線の吸収と発生
高いエネルギーを持つ粒子(電子など)や電磁波(X線,γ線)が原子に衝突すると,このエネルギーを吸収し,内殻の軌道電子が原子核外にはじき出され,内殻に空準位が生じる。はじき出された電子は光電子( photoelectron )と呼ばれる。
励起状態の原子では,空準位を電子で満たすため,外殻の電子が遷移(電子軌道間の電子遷移)する。この時,軌道間のエネルギー差に相当する電磁波が発生する。これを蛍光X線( X-ray fluorescence )又は特性X線( characteristic X-ray )という。
従って,X線の吸収による励起では,可視・紫外領域の吸光とは異なり,特定のエネルギーの電磁波に限定されず,光電子が発生できる特定のエネルギー(X線吸収端)以上のエネルギーを持つX線の照射でよい。
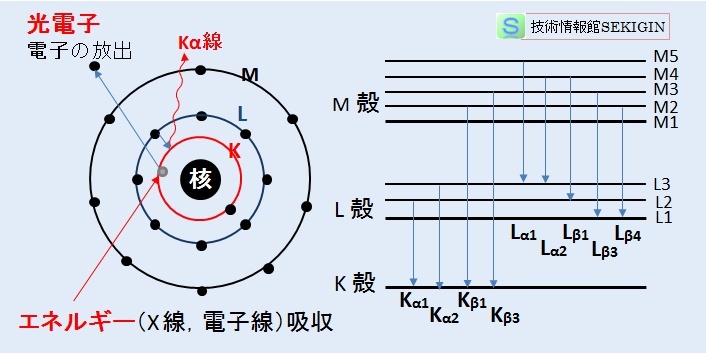
蛍光X線の発生原理と特性X線の種類
【参考】
光電子(こうでんし; photoelectron )
電物質に真空紫外光,X線などの光を照射したきに光電効果によって放出される電子( JIS K 0215「分析化学用語(分析機器部門)」 )。
すなわち,電磁波(光,X線,γ線)のエネルギーを吸収し,光電効果により原子,分子,または金属表面から放出される自由電子をいう。
光電効果(こうでんこうか; photoelectric effect )
物質が光のエネルギーを吸収して光電子(伝導電子を含む。)が放出される現象( JIS K 0215「分析化学用語(分析機器部門)」 )。
物質が光を吸収して自由電子(伝導電子を含む。)を生じる現象。電気伝導度の増加又は起電力が表れる内部光電効果と,固体表面から光電子が放出される外部光電効果とがある( JIS Z 8113「照明用語」)。
光電効果は,放出する過程により,気体が光を吸収して光電子を放出しイオンになる光電離(光イオン化),固体の表面から光電子が放出される外部光電効果,絶縁体や半導体内の価電子帯から放出された光電子が伝導帯へ上がって光伝導性などをもつ内部光電効果 (光伝導) ,固体接触面(半導体の p-n接合部など)で放出された光電子が示す光起電力効果などに分けられる。
単に光電効果といった場合には,電子が外に飛出す外部光電効果(光電子放出効果)をさすことが多い。
光起電効果(ひかりきでんこうか; photovoltaic effect )
金属と半導体の接触部又は半導体の接合部に光を照射すると,光を吸収して,その界面に自由キャリア対を生じ,正負の電荷がそれぞれ界面にできた電界によって移動し,負荷側が開路になっていると,電位差すなわち起電力を発生する現象( JIS Z 8113「照明用語」)。
光電子放出効果(こうでんしほうしゅつこうか; photoemissive effect )
固体内の電子が光の吸収によってエネルギーを得,固体表面から光電子となって逸脱する現象。光電管の原理である( JIS Z 8113「照明用語」)。
ページの先頭へ
特性 X線発生原理
電子の遷移は,電子状態遷移の選択律に従って起きる。許容遷移では,遷移前後の電子軌道が次の条件を満たすように起きる。
Δ n ≠ 0
主量子数 n が異なること,すなわち異なる電子殻間( L 核→ K 核,M 核→ L 核など)での遷移により,X線領域のエネルギーが得られる。
Δ l = ± 1
遷移前後の方位量子数 l の差が 1 となる遷移,例えば p軌道電子が異なる電子殻の s軌道( -1 )又は d 軌道( +1 )にだけ遷移できる。
Δ( l + s ) =0 , ± 1
方位量子数 l とスピン量子数 s の和(全角運動量,内量子数 j ともいわれる)の差が 0 又は± 1 となる遷移,例えば,差が 0 の場合は, p 軌道電子が異なる電子殻の s 軌道に遷移(Δ l = -1 )した時,電子のスピン量子数が -1/2 から +1/2 に変わる場合に遷移できることを意味する。
これに従うと,遷移できる原子のエネルギー順位は,K 核( 1s ),L 核は L1 ( 2s ) , L2 ( 2p , j = 1/2 ) , L3 ( 2p , j = 3/2 ) の 3種,M 核では M1 ( 3s ) , M2 ( 3p , j = 1/2 ) , M3 (3p , j = 3/2 ) , M4 ( 3d , j = 3/2 ) , M5 ( 3d , j = 5/2 ) の 5 種になる。
遷移する軌道で特性 X線の名称が異なる。
一般的には,例えば鉄 Kα1 線など古くから用いられるシーグバーン表記(エネルギー順)を用いている。
しかしながら,上図に示したように,この表記では,遷移した軌道間との関係が不明のため,IUPAC(国際純正・応用化学連合)では,遷移した軌道間(例えば,K – L2 )を明記する表記を推奨している。
【参考】
選択律( selection rule )
選択規則,選択則,選択の原理ともいう。量子力学において,一つの状態から他の状態への遷移が起きる場合の量子数の関係を規定した規則である。すなわち,系の二つの定常状態間の遷移が許容遷移であるか,禁制遷移であるかを決定する規則である。
許容遷移( allowed transition )と禁制遷移( forbidden transition )
2 つの状態間の電子遷移が制約を受けない場合を許容遷移,制約を受ける場合を禁制遷移という。
同じスピンを持った状態間の電子遷移はスピン許容遷移といい,異なるスピンを持った状態間の電子遷移はスピン禁制遷移といい,厳しい制約を受ける。
例えば,励起一重項状態から基底状態( S1 → S0 )の遷移は許容遷移であるが,励起一重項状態から三重項状態( S1 → T1 )や三重項状態から基底状態( T1 → S0 )の遷移は禁制遷移である。
スピン許容遷移は,強度が強く,大きいモル吸光係数を取れるが,スピン禁制遷移は強度が非常に弱く,小さいモル吸光係数となる。
ページの先頭へ
主な元素の特性 X線例
上図で紹介した Kα1 線と Kα2 線のエネルギーが近接しているので,一般的には,強度比が準位間の遷移確率に比例することを利用し,加重平均値を用いて Kα線として利用する。エネルギー差の小さいKβ1 線,Kβ2 線などについても同様に扱われる。
電子状態遷移の選択律に従うことから,電子軌道で紹介したように,1S 軌道の電子しかない水素( H ),ヘリウム( He )の特性X線(蛍光X線)は存在しないことになる。
X線の検出方法
X線の検出には,原理の異なるエネルギー分散型X線分光法( EDX : Energy Dispersive X-ray Spectroscopy )と波長分散型X線分光法( WDX :Wavelength Dispersive X-ray Spectrometer )がある。
EDX は半導体検出器と多チャンネル波高分析器の組み合わせで,X線のエネルギー別に検出する方法である。
WDX は,分光結晶を用いて波長分散し,それぞれの波長の強度を比例計数管で検出する方法である。
EDX には多元素を同時に検出できる利点があり,WDX には波長分解能(エネルギー分解能)が高い利点がある。
何れの方法も,原理的にはベリリウム( Be )の Kα線( 0.110 keV ,11.4 nm )より高いエネルギーのX線を検出できるとされるが,定量分析を考慮した実用上では,EDX でナトリウム( Na )の Kα線( 1.041 keV ,1.19 nm ),WDX でホウ素( B )の Kα線( 0.183 keV ,6.76 nm )が検出限界とされている。
なお,現行の検出装置で検出できないリチウム( Li )の Kα線は,エネルギー 0.054 keV ,波長 22.8 nm と遠紫外にも分類される軟X線である。
主な元素の特性X線
次に,主な元素の特性X線を紹介する。なお,表中の太字で示したエネルギーは,適切な検出強度,他の元素との重なりが少ないなどの理由で,蛍光X線分析や EPMA(電子プローブマイクロアナライザ)などの定性・定量分析に利用される特性X線である。
一般的には,通常の蛍光X線分析装置では,X線発生源の加速電圧として 50 kV 程度が用いられるので,実用的に定性・定量できる特性X線のエネルギーは 30KeV 程度までである。また,EPMA では,電子銃の加速電圧として 15kV 程度が用いられるので,検出できる特性X線の最大エネルギーは 15 keV 程度までとなる。
| 元素 | Kα | Kβ | Lα | Lβ | 元素 | Kα | Kβ | Lα | Lβ |
|---|---|---|---|---|---|---|---|---|---|
| 4 Be | 0.110 | 5 B | 0.183 | ||||||
| 6 C | 0.277 | 7 N | 0.392 | ||||||
| 8 O | 0.525 | 9 F | 0.677 | ||||||
| 11 Na | 1.041 | 12 Mg | 1.253 | ||||||
| 13 Al | 1.486 | 14 Si | 1.739 | ||||||
| 15 P | 2.013 | 2.199 | 16 S | 2.307 | 2.464 | ||||
| 17 Cl | 2.621 | 2.815 | 19 K | 3.312 | 3.589 | ||||
| 20 Ca | 3.690 | 4.012 | 0.341 | 0.345 | 22 Ti | 4.508 | 4.931 | 0.452 | |
| 23 V | 4.949 | 5.426 | 0.511 | 24 Cr | 5.411 | 5.946 | 0.573 | ||
| 25 Mn | 5.894 | 6.489 | 0.637 | 26 Fe | 6.398 | 7.057 | 0.705 | ||
| 27 Co | 6.924 | 7.648 | 0.776 | 28 Ni | 7.471 | 8.263 | 0.851 | ||
| 29 Cu | 8.040 | 8.904 | 0.930 | 30 Zn | 8.630 | 9.570 | 1.012 | 1.034 | |
| 31 Ga | 9.241 | 10.262 | 1.098 | 1.125 | 32 Ge | 9.874 | 10.979 | 1.188 | 1.218 |
| 33 As | 10.530 | 11.722 | 1.282 | 1.317 | 34 Se | 11.207 | 12.494 | 1.379 | 1.419 |
| 35 Br | 11.907 | 13.288 | 1.480 | 1.526 | 40 Zr | 15.744 | 17.660 | 2.042 | 2.124 |
| 42 Mo | 17.441 | 19.605 | 2.293 | 2.394 | 46 Pd | 21.121 | 2.833 | 2.990 | |
| 47 Ag | 22.101 | 2.984 | 3.150 | 48 Cd | 23.106 | 3.133 | 3.316 | ||
| 50 Sn | 25.191 | 3.443 | 3.662 | 56 Ba | 32.062 | 4.465 | 4.827 | ||
| K , L , M 線 | |||||||||
| 元素 | Kα | Lα | Lβ | Mα | 元素 | Kα | Lα | Lβ | Mα |
| 58 Ce | 34.566 | 4.839 | 5.261 | 0.883 | 74 W | 58.856 | 8.396 | 9.671 | 1.774 |
| 78 Pt | 66.241 | 9.441 | 11.069 | 2.048 | 79 Au | 68.177 | 9.712 | 11.440 | 2.120 |
| 48 Hg | 70.154 | 9.987 | 11.821 | 2.195 | 82 Pb | 74.221 | 10.550 | 12.612 | 2.342 |
λ = h c E-1
で与えられる。( 1keV の光子の波長は約 1.24 nm )
ページの先頭へ