第四部:無機化学の基礎 金属元素(典型元素)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,周期表 13族の金属元素について, 【周期表 13族とは】, 【アルミニウム】, 【ガリウム】, 【インジウム,タリウム,ニホニウム】 に項目を分けて紹介する。
周期表 13族とは
周期表 13族のホウ素( B )は半金属(非金属性の強い)に分類され,金属元素に分類されるのはアルミニウム( Al ),ガリウム( Ga ),インジウム( In ),タリウム( Tl ),ニホニウム( Nh )である。
なお,太字は実用される元素を示す。また,ガリウム,インジウム,タリウムは,レアメタルに分類される元素である。原子番号 113 のニホニウムは,人工放射性物質で実用例のない元素である。
次には,実用される周期表 13族の金属元素(単体)の基礎物性を紹介する。なお,比較のため,身近な金属単体として,鉄,銅の値も併記する。
なお,ポーリングの電気陰性度,イオン化エネルギーは別途紹介している。なお,これらの値は,算出に用いる解離エネルギー値や結合エネルギー値の改訂で変わるので,紹介した値は最新値ではなく,引用文献での値である。
| 元素記号 | Al | Ga | In | Ta | Fe | Cu |
|---|---|---|---|---|---|---|
| 原子番号 | 13 | 31 | 49 | 81 | 26 | 29 |
| 原子量 | 26.98 | 69.723 | 114.818 | 204.38 | 55.85 | 63.55 |
| 融点(℃) | 660.3 | 29.76 | 156.6 | 304 | 1538 | 1084 |
| 密度(×106 gm-3) | 2.70 | 5.91 | 7.31 | 11.85* | 7.87 | 8.94 |
| 結晶構造 | fcc | *1 | *2 | hcp | bcc | fcc |
| 格子定数(×10-10 m) | 4.0496 | *1 | 3.244 , 4.938 | 3.456 , 5.525 | 2.867 | 3.615 |
| モース硬度 | 2.8 | 1.5 | 1.2 | 1.2 | 4.0 | 3.0 |
| 電気抵抗(×10-8 Ωm:20℃) | 2.82 | 27.0 | 8.37 | 18 | 9.61 | 1.68 |
| 熱伝導率( W m-1K-1:300K) | 237 | 40.6 | 81.8 | 46.1 | 80.4 | 401 |
備考: hcp (六方最密充填,ちよう密六方),fcc (立方最密充填,面心立方格子),bcc (体心立方格子)
*1: Ga斜方晶系 格子定数 4.511 , 4.517 , 7.645
*2:歪んだ fcc(立方最密充填構造)
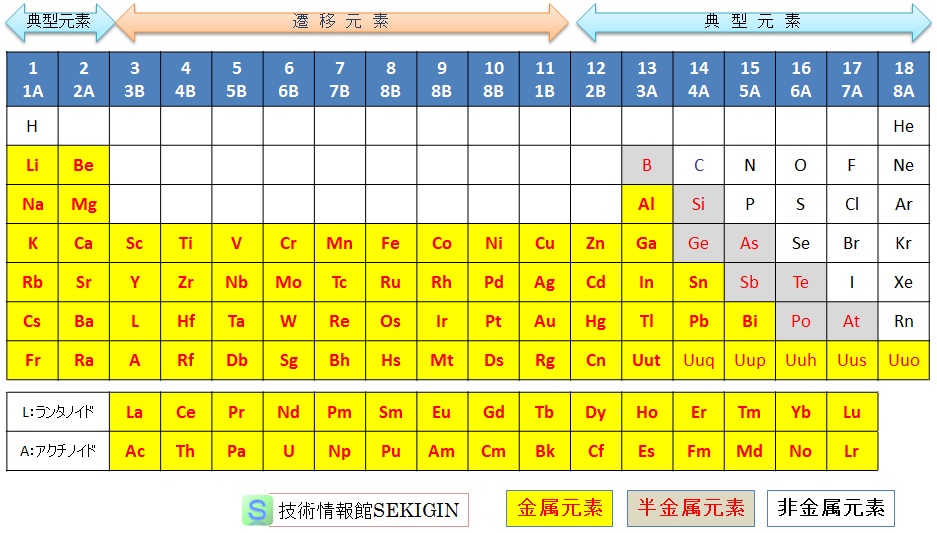
周期表(2015年)
ページの先頭へ
アルミニウム( Al )
アルミニウム( Al )は,利用可能な天然の化合物として,広く多量に分布している元素(クラーク数:酸素,ケイ素に次いで第 3位)である。
単体は,ボーキサイト(酸化アルミニウムを多量に含む鉱物)を原料とし,得られた酸化アルミニウム(アルミナ)を溶融・電気分解(ホール・エルー法)して得るのが一般的である。
アルミニウム単体は,常温常圧で熱伝導性・電気伝導性に優れ,軽量で加工性が高いので,広い範囲で実用されている。
反応性
アルミニウム単体は,イオン化エネルギーが小さく,
粉末や細線の状態では,一旦引火すると激しく燃焼( 4Al + 3O2 → 2Al2O3 ⊿H = -1657 kJ /mol :粉塵爆発を起こす場合があるので第2類危険物に分類)する。
これを利用し,アルミニウム粉末,酸化鉄( Fe2O3 )粉末の混合物にマグネシウムリボンを点火剤として用い燃焼させることで,鉄を還元( Fe2O3 + 2Al → 2Fe + Al2O3 )できる(テルミット反応)。この反応を利用した溶接技術をテルミット溶接という。
酸化性のない酸(例えば希硫酸など)や強塩基に接触すると溶解する。酸,塩基の何れにも溶解するので,アルミニウムは両性金属と呼ばれる。
酸との反応
2Al + 3H2SO4 ( 2H+ + SO42- ) → Al2 (SO4)3 ( 2Al3+ + 3SO42- ) + 3H2↑
強塩基との反応
2Al + 2NaOH ( Na+ + OH- ) + 10H2O → 2NaAl(OH)4 (H2O)2 (Na+ + Al(OH)4 (H2O)2- ) + 3H2↑
アルミニウムの酸化物( Al2O3 ),水酸化物( Al(OH)3 )とも酸,塩基の水溶液と反応し塩を生成するので,両性酸化物,両性水酸化物といわれる。
アルミニウム単体の反応性は高いが,中性水や常温の空気中では,酸素や水と反応し表面が不動態被膜( Al2O3 )で覆われ,長期間にわたり安定的に存在できる。人工的に酸化被膜を形成する処理(陽極酸化処理)を施したものをアルマイトという。
水中にハロゲンイオン(塩化物イオンなど)を多く含む場合は,不動態被膜が破壊され,部分的な腐食(孔食)が起きる。
用途例
アルミニウム単体の純金属としての用途は,硬貨( 1円)以外にはほとんどなく,ジュラルミンなどのアルミニウム合金として様々な用途(アルミ箔,アルミ缶,鍋など食器,建築資材,家電品,自動車部品,鉄道車両部品,航空機機材など)に用いられている。
アルミニウム化合物として,モース硬度 9と高い酸化アルミニウム( Al2O3 , 通称アルミナ)は,研磨剤(コランダム)として用いられる。また人工のルビー,サファイアの原料としてもいいられる。
アルミニウム,カリウムと硫酸の複塩であるミョウバン ( AlK (SO4)2・12H2O )は,料理用途の他に水の濁りを除く清澄(せいちょう)剤,紙のにじみ止め,染色剤,皮なめし剤などの用途がある。
【参考】
クラーク数( Clarke number )
地表部付近から海水面下 10マイル(16km)までの元素の割合で,存在度が 1%以上の元素には,酸素( O ; 49.5),けい素( Si ; 25.8),アルミニウム( Al ; 7.56),鉄( Fe ; 4.70),カルシウム( Ca ; 3.39),ナトリウム( Na ; 2.63),カリウム( K ; 2.40),マグネシウム( Mg ; 1.93)が挙げられる。ちなみに,その他の身近な元素の存在度は,水素( H ; 0.83),塩素( Cl ; 0.19),炭素( C ; 0.08),窒素( N ; 0.03)である。
なお,太陽系の元素存在度(宇宙存在度:cosmic abundance of elements)では,水素( H )とヘリウム( He )が 99%以上を占め,その他で存在量の多い順に,酸素( O ),炭素( C ),ネオン( Ne ),窒素( N ),マグネシウム( Mg ),シリコン( Si ),鉄( Fe ),カルシウム( Ca )が挙げられている。
ページの先頭へ
ガリウム( Ga )
天然には,鉱石・鉱物としてガリウムを主成分とするガライト( CuGaS2 )などが存在するが,工業的には,亜鉛を得る際の亜鉛鉱石の不純物,アルミニウムを得る際のボーキサイトに含まれる成分から副産物として得られる。
反応性
ガリウム単体は,常温で表面に酸化被膜を形成(不動態化)し,空気と水に対して不活性である。
圧力,温度で幾つかの結晶構造(α,β,γ,δなど)がある。常温・常圧では斜方晶系が安定(密度 5.91×106 gm-3 )な軟らかい金属である。融点は 29.76℃と低いが,沸点は 2403 ℃と非常に高い。融点の低さは,対称性の低い不安定な結晶構造に起因していると考えられている。
ガリウム単体は,液体の密度(融点の液体 6.095×106 gm-3 )が固体の密度(室温付近 2.7×106 gm-3 )より大きい。このような,液体が固体より密度の大きい材料は,有名な水の他に,周期表 14族のケイ素( Si ),ゲルマニウム( Ge ),周期表 15族のアンチモン( Sb ),ビスマス( Bi )などに限られる。
ガリウム単体は,アルミニウムと同様に,酸,塩基に溶ける両性金属である。ガリウム単体は,強酸に溶解し,Ga2 (SO4)3 や Ga (NO3)3 などのガリウム(III) 塩を生成する。
また,アルカリ金属の水酸化物溶液に溶解してガリウム酸イオン Ga (OH)4- を形成して溶解する。
用途例
ガリウム単体は,広い温度範囲( 29.76~2403 ℃)で液体のため,水銀に変わる液柱温度計に用いられる。融点が人肌以下であることを利用し,スプーン曲げなどのマジックでの利用例もある。
また,融点 -19 ℃と常温で液体の低融点合金(ガリンスタン: Ga 68.5 % , In 21.5 % , Sn 10 %)の主成分として用いられる。
酸化ガリウム(III) Ga2O3 は,半導体素子やガスセンサー等に用いられる。酸化ガリウム(III) と金属ガリウムの真空中加熱で酸化ガリウム(I) Ga2O が得られる。酸化ガリウム(I) は,硫酸を硫化水素まで還元できる非常に強い還元剤である。
ガリウム単体を高温( 1050℃)でアンモニアと反応させると青色発光ダイオードの素材として知られる窒化ガリウム GaN が得られる。
ヒ素,リン,アンチモンもガリウムと直接反応し,ヒ化ガリウム GaAs は,赤色発光ダイオード,半導体レーザーなどの半導体材料として,リン化ガリウム GaP の単結晶は,発光ダイオード(赤色,黄色,緑色)用の基板として,アンチモン化ガリウム GaSb は,赤外発光ダイオードや光電変換素子などに用いられる。
チオガリウム酸の水銀塩 HgGa2S4 は蛍光体として用いられる。
ページの先頭へ
インジウム,タリウム,ニホニウム
インジウム( In )
インジウムは,閃亜鉛鉱( ZnS )や方鉛鉱( PbS )に含まれ,亜鉛や鉛を得る時の副産物として回収されている。
単体は,常温の空気,中性,塩基性の水に対して安定であるが,酸に溶解する。
用途例
酸化インジウム( In2O3 )に酸化錫( SnO2 )を添加した化合物,酸化インジウム錫 ITO ( Indium Tin Oxide ) は可視光の透過率約 90%で導電性があるため,液晶パネル,有機 ELなどのフラット・パネル・ディスプレイ向けの電極に用いられる。これがインジウムの主用途である。
他に,歯科用合金,はんだ材料, 高レベルの真空パッキンなどに用いられる。熱伝導の良さから,箔状に延ばしたものがクライオポンプ等に用いられている。
タリウム( Tl )
タリウムは,銅,鉛や亜鉛などの硫化鉱物中に微量に含まれている。これら金属の精製の際に副産物として回収される。タリウムは,第 13族の元素であるが,1価の陽イオン( Tl+ )が安定である。
酸化性のない酸には溶解しないが,酸化性の酸(硝酸や熱濃硫酸など)で溶解する。
希硝酸に対しては,
3Hg + 8HNO3 ( H+ + NO3- ) → 3Hg(NO3)2 ( Hg2+ + 2NO3- ) + 2NO↑+ 4H2O
と一酸化窒素を発生し,濃硝酸に対しては,
Hg + 4HNO3 ( H+ + NO3- ) → Hg(NO3)2 ( Hg2+ + 2NO3- ) + 2NO2↑+ 2H2O
と二酸化窒素を発生し,熱濃硫酸に対しては,
Hg + 2H2SO4 ( 2H+ + SO42- ) → HgSO4 ( Hg2+ + SO42- ) + SO2↑+ 2H2O
と二酸化硫黄を発生し溶解する。
用途例
タリウムは,光学レンズ,低温用温度計,半導体,シンチレーションカウンター(タリウム活性化ヨウ化セシウム結晶),軸受け用合金の添加剤などに利用されている。
化合物は,重金属の中でも特に強い毒性を持ち,摂取すると神経障害を起こすので殺鼠剤の原料として,硫酸タリウム(I) ( Tl2SO4 ) ,酢酸タリウム(I) ( CH3COOTl ) ,硝酸タリウム(I) ( TlNO3 ) などが用いられる。
鉱物の分離やリサイクルで廃棄物から金属を分離(比重選鉱法)する際に,比重の重い液体として,ギ酸タリウムとマロン酸タリウムの混合水溶液(クレリチ溶液)が用いられる。
ニホニウム( Nh )
ロシアのドゥブナ合同原子核研究所,アメリカのローレンス・リバモア国立研究所,オークリッジ国立研究所,2004年日本の理化学研究所がそれぞれ元素合成に成功したと報告し,理化学研究所に命名権が認められ,暫定名称ウンウントリウム( Uut )は,2016年にニホニウム( nihonium,Nh )と命名された。
【参考】
比重選鉱法(重液選鉱)
比重の違いを利用して鉱物を選別する方法である。この方法は,鉱物の選別以外に,宝石の鑑定にも用いられる。
鉱物や宝石の比重は,例えばオパール( 2.15 ),水晶( 2.7 ),角閃石( 3.3 ),ダイヤモンド( 3.52 ),ルビー( 4.0 ),磁鉄鉱( 5.2 ),自然金( 15.2~19.3 )と広く分布する。
これらの分別に活用される比重の大きい溶液(重液),比重範囲別の調整の概要を紹介する。
~ 2.89 :トリブロモメタン( CHBr3 俗称プロモホルム:刺激性・摩酔性)をトルエン希釈で調整。
~ 3.33 :ヨウ化メチレン( CH2I2 )をトルエン希釈で調整。
~ 4.25 :クレリチ溶液(マロン酸タリウムとギ酸タリウムの飽和水溶液)を水希釈で調整。
~ 5.00 :クレリチ溶液を加熱(~ 90℃)
ページの先頭へ