第四部:無機化学の基礎 金属元素(遷移元素)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
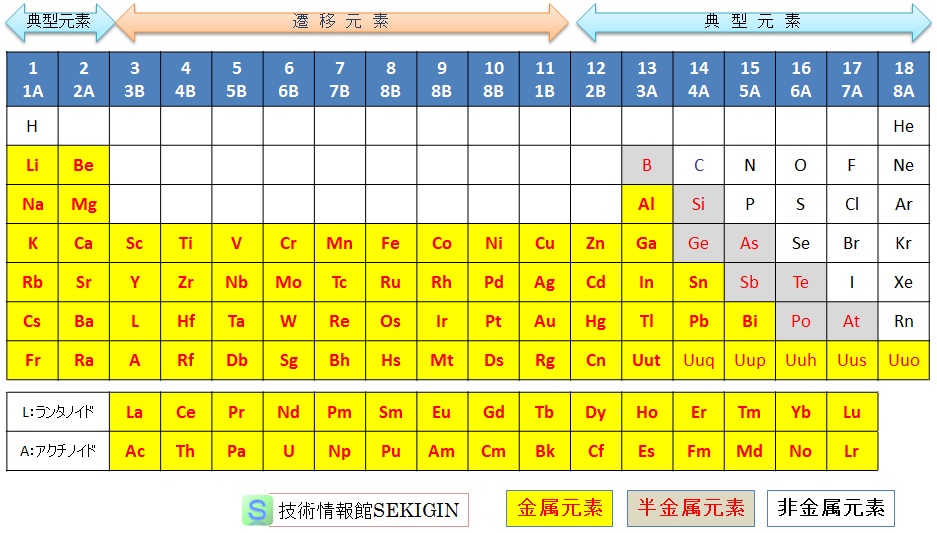
ここでは,遷移元素周期表 3族(ランタノイド系ネオジム以後)で実用される金属元素について, 【周期表 3族:ランタノイド系とは】, 【プロメチウム】, 【サマリウム】, 【ユウロビウム】, 【ガドリウム】, 【テルビウム】, 【ジスプロシウム】, 【ホルミウム】, 【エルビウム】, 【ツリウム】, 【イッテリビウム】, 【ルテチウム】 に項目を分けて紹介する。
周期表 3族:ランタノイド系とは
周期表 3族に分類される元素で,前項の【周期表 3族 】で紹介したランタン( La ),セリウム( Ce ),プラセオジム( Pr ),ネオジム( Nd )を除く,ランタノイド系のプロメチウム( Pm ),サマリウム( Sm ),ユウロピウム( Eu ),ガドリウム( Gd ),テルビウム( Tb ),ジスプロシウム( Dy ),ホルミウム( Ho ),エルビウム( Er ),ツリウム( Tm ),イッテリビウム( Yb ),ルテチウム( Lu )の概要を紹介する。
なお,実用材料などに利用される主な元素を太字で示した。これらの元素は,全て,希土類元素(レアアース)といい,レアメタルに分類される元素である。
次表には,これらの中から実用に供される主な元素の基礎物性を紹介する。比較のため,身近な金属単体として,アルミニウム,鉄の値も併記する。
【参考】
レアメタル( rare metal )
希少金属ともいわれ,以下の ①~④ のどれか一項目を満たし,かつ ⑤ の条件にあてはまるものをいう。
① 存在する量が少ない
② 鉱床を作らず,広く薄く分布している
③ 鉱床を作っても,特定の国や地域に限定されている
④ 鉱物からの取り出し,精製が難しい
⑤ 現代の産業に欠かせない素材である
レアメタル以外の金属はコモンメタル( common metal :汎用金属)という。チタン( Ti )のように,④と⑤でレアメタルに分類される元素は,精錬技術の向上などによりレアメタルからコモンメタルに変更される可能性がある。
| 元素記号 | Sm | Eu | Gd | Dy | Er | Yb | Al | Fe |
|---|---|---|---|---|---|---|---|---|
| 原子番号 | 62 | 63 | 64 | 66 | 68 | 70 | 13 | 26 |
| 原子量 | 150.36 | 151.96 | 157.25 | 162.5 | 167.259 | 173.054 | 26.98 | 55.85 |
| 融点(℃) | 1794 | 826 | 1312 | 1407 | 1529 | 824 | 660.3 | 1538 |
| 密度(×106 gm-3) | 7.52 | 5.264 | 7.90 | 8.54 | 9.066 | 6.90 | 2.70 | 7.87 |
| 結晶構造 | *1 | bcc | hcp | hcp | hcp | fcc | fcc | bcc |
| 格子定数(×10-10 m) | 8.996 , 23.2 | 4.606 | 3.636 , 5.783 | 3.590 , 5.873 | 3.559 , 5.587 | 5.486 | 4.0496 | 2.867 |
| ビッカース硬度( MPa ) | 412 | 167 | 570 | 540 | 589 | 206 | 167 | 608 |
| 電気抵抗(×10-8 Ωm:20℃) | 94 | 90 | 131* | 92.6 | 86 | 25 | 2.82 | 9.61 |
| 熱伝導率( W m-1K-1:300K) | 13.3 | 13.9 | 10.6 | 10.7 | 14.5 | 38.5 | 237 | 80.4 |
備考: hcp (六方最密充填,ちよう密六方),fcc (立方最密充填,面心立方格子),bcc (体心立方格子)
*1:三方晶系( ACACBCBAB の 9 層ずつ繰り返す構造)
周期表(2015年)
ページの先頭へ
プロメチウム( Pm )
天然にはウラン鉱石中に,ウランの核分裂生成物としてプロメチウム 147が僅かに認められている。プロメチウムの物理的,化学的性質には不明な点が多い。
プロメチウムは,原子番号 61 ,原子量(145),密度 7.26×106 gm-3 の銀白色の金属で,常温・常圧では複六方最密充填が安定な構造であるが,安定同位体は存在せずすべて放射性同位体である。最も長い半減期の同位体はプロメチウム 145 の 17.7 年である。
用途例
放射性を利用した用途として,過去に夜光塗料に用いられていたが,現在では日本国内で使用されていない。
【参考】
放射性同位体( radioactive isotope )
同位体のうち,不安定で放射性壊変をする核種。ラジオアイソトープ,又は放射性核種ともいう(JIS K 0214「分析化学用語(環境部門)」)。
同位体(isotope)とは,原子番号が同一の元素で互いに質量数の異なる一連の原子(JIS K 0215「分析化学用語(分析機器部門)」)。
半減期( radioactive half-life )
放射性半減期とは,放射性核種の原子の数が,放射性壊変によって半分になるのに要する時間をいう。
ページの先頭へ
サマリウム( Sm )
サマリウムは,地殻中に比較的多く含まれ,ありふれた元素ともいえるが,単体を容易に得ることができないためレアメタルに分類される。
サマリウムは,他の希土類元素と同様に希土類鉱石のモナザイト: (Ce, La, etc.)PO4 ,バストネサイト: (Ce, La, etc.)(CO3)F ,やサマルカイト(サマルスキー石)など多くの鉱物中に含まれる。工業的には,モナザイトやバストネサイトから生産される。
サマリウム単体は,灰白色の軟らかい金属で,常温・常圧では三方晶系が安定な構造である。結晶構造は,高温になると六方最密充填( hcp ),体心立方構造( bcc )に転移する。
反応性
サマリウム単体は,空気中で徐々に酸化され,表面に酸化被膜を形成する。150℃以上では激しい酸化反応で自然発火する。最も安定な酸化物は,常温で常磁性を示す Sm2O3 である。
冷水とは徐々に,温水となら直ちに反応し水酸化物( Sm(OH)3 )を形成する。希硫酸に容易に溶解し,Sm+3イオンとなり黄色~薄緑色を呈する。
サマリウムは,ハロゲン,ホウ素,酸素族元素,窒素族元素などと化合物(二元化合物)を形成する。また,多くの金属元素と合金を形成できる。
用途例
ネオジム磁石に次いで磁力の大きいサマリウムコバルト磁石( SmCo5 又 Sm2Co17 の金属間化合物)として,小型モーター,ヘッドホン,スマートフォン,風力発電等で実用されている。
有機化学において,トリフルオロメタンスルホナトサマリウム( Sm(CF3SO3)3 )などが触媒として実用されている。ヨウ化サマリウム(Ⅱ)( SmI2 )は,有機合成における還元剤として用いられる。
他には,陶器やガラス,コンデンサや誘電体に酸化サマリウム用いられている。
ページの先頭へ
ユウロビウム( Eu )
ユウロピウムは,天然では斜長石などアルカリ土類金属を含む鉱物中に見出され,希土類鉱石中の含有率は低い。
工業的には,酸化セリウムを得るために用いる希土類鉱石のモナザイト: (Ce, La, etc.)PO4 ,バストネサイト: (Ce, La, etc.)(CO3)F から随伴的に得られるものを用いる。
ユウロピウム単体は,銀白色の金属で,常温・常圧では体心立方構造( bcc )が安定な結晶構造である。
反応性
ユウロピウム単体は,反応性が高く,空気中で速やかに酸化される。水との接触では,周期表 2族のカルシウムと同程度の反応性を持ち,熱水・酸に容易に溶解する。
ユウロピウムは,2価の状態が安定で,硫酸ユウロピウム(Ⅱ)( EuSO4 )は水に難溶など,2価の化合物は,周期表 2族のストロンチウムに類似の性質を示す。
用途例
硫黄,セレンなどの周期表 16族元素との化合物は,磁性半導体として用いられ,蛍光体には酸化イットリウム(Ⅲ)に酸化ユウロピウム(Ⅲ)をドープした化合物が用いられる。
ページの先頭へ
ガドリウム( Gd )
天然には,希土類鉱石のモナザイト: (Ce, La, etc.)PO4 ,バストネサイト: (Ce, La, etc.)(CO3)F やガドリン石( Y2FeBe2Si2O10 )に含まれている。
反応性
ガドリウム単体は,常温・常圧で六方最密充填構造( hcp )が安定な結晶で,水に徐々に溶解し,酸には容易に溶解する。
用途例
ガドリニウムの錯体は,磁性材料や MRI 検査用の造影剤に利用されている。
ガドリニウムの中性子吸収断面積が大きいので,原子炉の制御材料にも用いられている。。
ページの先頭へ
テルビウム( Tb )
天然での存在量は比較的少なく,ガドリン石( Y2FeBe2Si2O10 ),ゼノタイム( YPO4 )に含まれる。
テルビウムは,原子番号 65 ,原子量 158.93 の元素で,常温・常圧で六方最密充填構造( hcp )が安定な密度 8.23×106 gm-3 ,融点 1356℃の金属である。
。
反応性
テルビウム単体は,空気中で表面が酸化され,高温で酸化物は Tb2O3 から Tb4O7 となる。ハロゲンとも激しく反応する。水に徐々に溶解し,酸には容易に溶解する。
用途例
蛍光体の材料や光磁気ディスクの磁性膜の材料,プリンターの印字ヘッドに利用される。
ページの先頭へ
ジスプロシウム( Dy )
天然では,ガドリン石( Y2FeBe2Si2O10 ),ゼノタイム( YPO4 )に含まれる。
ジスプロシウム単体は,常温・常圧で六方最密充填構造( hcp )が安定な金属である。
反応性
空気中で表面が酸化され,高温では酸化物 Dy2O3 となる。水に徐々に溶解し,酸には容易に溶解する。
85K 以下の低温で強磁性を示す。この温度を強磁性転移温度( TN )という。
用途例
中性子吸収断面積が大きく,鉛又はガドリニウムとの合金として原子炉の制御用材料に用いられる。光磁気ディスクの材料,ネオジム磁石の添加剤,蓄光剤の添加剤,高輝度放電ランプなどに利用されている。
【参考】
磁気相転移( magnetic phase transition )
磁性体は,低温で規則的なスピン配列をとるが,高温では熱攪乱のため不規則なスピン配列の常磁性( paramagnetism )の状態に変る。固体が強磁性( ferromagnetism )の場合には強磁性相転移といい,反強磁性( diamagnetism )の場合には反強磁性相転移とよばれる。
この変化は,ある温度を境に急激に起こり,この温度を転位温度という。強磁性体やフェリ磁性体の転移温度をキュリー温度( Curie temperature ),反強磁性体の転移温度はネール温度(Néel Temperature)と呼ばれる。
キュリー温度( Curie temperature,記号Tc)
物理学現象で,強磁性体が常磁性体に変化する転移温度,又は強誘電体が常誘電体に変化する転移温度をいい,キュリー点( Curie point )ともいう。
ページの先頭へ
ホルミウム( Ho )
ホルミウムは,原子番号 67 ,原子量 164.93 の元素で,天然では,ガドリン石( Y2FeBe2Si2O10 ),ゼノタイム( YPO4 )に含まれる。
ホルミウム単体は,常温・常圧で六方最密充填構造( hcp )が安定な,密度 8.79×106 gm-3 ,融点1461℃の金属である。
反応性
空気中で表面が酸化される。水には徐々に溶解し,酸には容易に溶解する。
用途例
希少で高価なため,あまり利用されていない。
ページの先頭へ
エルビウム( Er )
天然では,ガドリン石( Y2FeBe2Si2O10 ),ゼノタイム( YPO4 )に含まれる。
エルビウムの単体は,常温・常圧で六方最密充填構造( hcp )が安定な灰色の金属である。空気中で表面が酸化される。
反応性
高温の空気中では酸化エルビウム(Ⅲ) Er2O3 となり,水に徐々に溶解し,酸には容易に溶解する常磁性の金属である。
用途例
酸化エルビウムは,ガラスの着色剤(ピンク色)に用いられる。光増幅器の光ファイバーや固体レーザーの添加剤として利用されている。
ページの先頭へ
ツリウム( Tm )
天然では,ガドリン石( Y2FeBe2Si2O10 ),ゼノタイム( YPO4 )に含まれる。
ツリウムは,原子番号 69 ,原子量 168.934 の元素である。ツリウムの単体は,常温・常圧で六方最密充填構造( hcp )が安定な密度 9.32×106 gm-3 ,融点 1545℃の金属である。
反応性
空気中で表面が酸化され,高温では速やかに酸化され,酸化物 Tm2O3 となる。冷水に徐々に溶解し,熱水には素早く溶解する。酸には容易に溶解する。
用途例
ツリウムの用途は,エルビウム( Er )と同様に,光増幅器の光ファイバーの添加剤に利用されている。
ページの先頭へ
イッテリビウム( Yb )
天然では ,ゼノタイム( YPO4 ),ガドリン石( Y2FeBe2Si2O10 ),モナザイト: (Ce, La, etc.)PO4 ,バストネサイト: (Ce, La, etc.)(CO3)F に含まれる。単体は,常温・常圧で面心立方構造( fcc )が安定な灰色の金属である。
反応性
常温・常圧の空気中では,表面酸化で留まりその後の酸化が抑制される。水には徐々に溶解し,酸、液体アンモニアには容易に溶解する。
用途例
ガラスの着色剤,固体レーザー(YAG(イットリウム・アルミニウム・ガーネット)レーザー)の添加剤として用いられている。
ページの先頭へ
ルテチウム( Lu )
天然には,モナザイト: (Ce, La, etc.)PO4 ,バストネサイト: (Ce, La, etc.)(CO3)F などに存在する。
ルテチウムは,原子番号 71 ,原子量 174.967 の元素で,単体は,常温・常圧で六方最密充填構造( hcp )が安定で,密度 9.84×106 gm-3 ,融点 1652℃の金属である。
反応性
単体は,常温の大気中では表面が薄い酸化物で覆われ,高温では酸化物 Lu2O3 になる。
用途例
実用に関しては,研究段階である。
ページの先頭へ