第四部:無機化学の基礎 生活と無機(燃焼ガスの処理)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化石燃料の燃焼に伴う排気ガスに関連し, 【燃焼排ガス処理とは】, 【窒素酸化物( NOx )の発生】, 【排煙脱硝装置について】, 【硫黄酸化物( SOx )の発生】, 【排煙脱硫装置について】 に項目を分けて紹介する。
【燃焼排ガス処理とは】
化石燃料の燃焼では,標準的な燃焼反応の生成物である一般化炭素,二酸化炭素及び水以外に,燃料に含まれる不純物及びその燃焼反応物などが排気ガスとして排出される。さらに,高温燃焼では空気の主成分である窒素の酸化反応生成物( NOx )が排気ガスに含まれる。
燃焼の排気ガスに関連し,後述の環境関連の法整備で紹介するように,人の健康や環境に与える影響を低減するための法が整備された。法の整備・制定された基準に応じるため,燃焼排気ガスの処理技術が種々開発されている。
ここでは,排ガス処理の理解に資するため,石炭火力発電で用いる浄化技術を中心に,硫黄酸化物( SOx )と窒素酸化物( NOx )について,発生のメカニズムと排煙処理技術を紹介する。
環境関連の法整備
経済の高度成長に伴い国土開発の広域化・大規模化により,環境破壊に対するそれまでの個別の法律での対応が困難になり,1972 年(昭和 47 年)に自然環境保全法が制定された。
さらには,産業活動により引き起こされた公害問題が顕在化し,日本の四大公害病と呼ばれる水俣病,第二水俣病,四日市ぜんそく,イタイイタイ病の発生を受け,1967年(昭和 42年)に公害対策基本法が公布・施行された。
なお,この法律では,大気汚染,水質汚濁,土壌汚染,騒音,振動,地盤沈下,悪臭の 7つを公害と規定していた。
1993年までは,公害対策を公害対策基本法で,自然環境対策を自然環境保全法で行っていた。
しかしながら,この法体系では複雑化・地球規模化する環境問題に対応できず,1993年(平成 5 年)に公害対策基本法を廃止し,環境基本法が制定され,これとの整合性を確保するため,自然環境保全法も改訂された。
環境基本法は,日本の環境政策の根幹を定める基本法で,具体的施策は規定の趣旨に基づく個別の法制上および財政上の措置により実施される。
参考:自動車排出ガス規制について
「自動車排出ガス規制( vehicle emissions control )」は,自動車のエンジンから排出される一酸化炭素( CO ),窒素酸化物( NOx ),炭化水素類( HC ),黒煙などの大気汚染物質の上限を定めた規制をいう。
自動車排出ガス規制では,1968年(昭和 43年)制定の大気汚染防止法,1992年(平成 4年)制定の自動車から排出される窒素酸化物及び粒子状物質の特定地域における総量の削減等に関する特別措置法(自動車 NOx・PM 法),都道府県によるディーゼル車規制条例などが含まれる。
日本国内では,次に示す 3種の方法を用いて自動車排出ガス規制が実施されている。
第一には,道路運送車両法,道路運送車両の保安基準による単体規制,第二に車両の新規登録,移転登録及び継続登録時に実施される自動車 NOx・PM 法による車種規制,第三に東京都・埼玉県・千葉県・神奈川県,大阪府・兵庫県・愛知県で実施するディーゼル車規制条例やマイカー規制などの運行規制である。
ページの先頭へ
窒素酸化物( NOx )の発生
発生機構による区分
フューエル NOx
生物由来の石炭などは,たんぱく質等を由来とする窒素を含む有機化合物を含む。従って,これらのが燃焼した場合には,窒素酸化物( NOx ;NO2 が多い)が発生する。この窒素酸化物をフューエル NOx と呼ぶ。
サーマル NOx
ガソリンエンジンやディーゼルエンジンなどの空気を用いた高温での燃焼において,空気中の窒素ガス( N2 )の酸化によっても窒素酸化物が生成される。
例: N2 + O2 → 2NO ,2NO + O2 → 2NO2
この過程で生成する窒素酸化物( NOx )をサーマル NOx と呼ぶ。
石炭の燃焼で生成する窒素酸化物は,燃焼温度が低いため,そのほとんどがフューエル NOx である。
窒素化合物をほとんど含まない燃料を用いる自動車や天然ガスボイラ(家庭用調理ガス器具を含む)などから排出される窒素酸化物はサーマル NOx が主である。
窒素酸化物の種類
窒素酸化物とは,酸化数 +1 の亜酸化窒素(一酸化二窒素)( N2O ),酸化数 +2 の一酸化窒素( NO ),酸化数 +3 の三酸化二窒素( N2O3 ),酸化数 +4 の二酸化窒素( NO2 ),四酸化二窒素( N2O4 ),酸化数 +5 の五酸化二窒素( N2O5 )などの総称である。
この中で,亜酸化窒素(一酸化二窒素)( N2O )は,温室効果ガス,オゾン層破壊物質として,二酸化窒素( NO2 )は毒性が強く,環境汚染物質(酸性雨など)や光化学スモッグの原因物質として問題となる。
二酸化窒素(酸化数 +4 )は,自己酸化還元反応を起こし,水との接触で硝酸( HNO3 :酸化数 +5 )と亜硝酸( HNO2 :酸化数 +3 )が生成されるため,酸性雨の一因と考えられている。
2NO2 + H2O → HNO3 + HNO2
ページの先頭へ
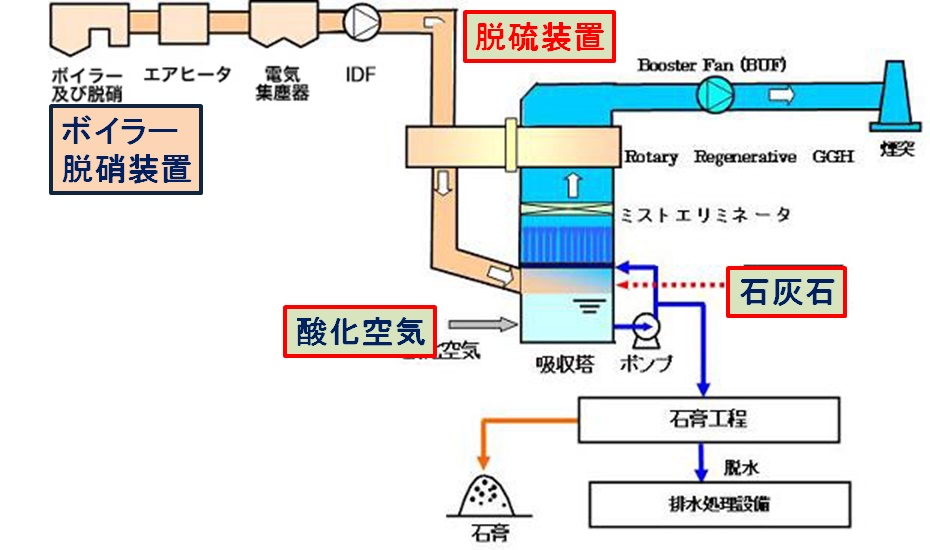
排煙脱硝装置について
下図に示すように,触媒層入口で窒素の酸化数 -3 のアンモニア( NH3 )を吹き込み,酸化数 +2 の NO ,酸化数 + 4 の NO2 などを無害な窒素単体( N2 :酸化数 0 )にする酸化・還元反応(触媒反応)を利用している。
触媒は,TiO2 を主成分とし,活性成分であるバナジウム(V),タングステン(W)などが添加されたものなどが用いられる。
この触媒は,350 ℃以上で機能し,例えば次のような反応が起きる。
4NO + 4NH3 +O2 → 4N2 + 6H2O
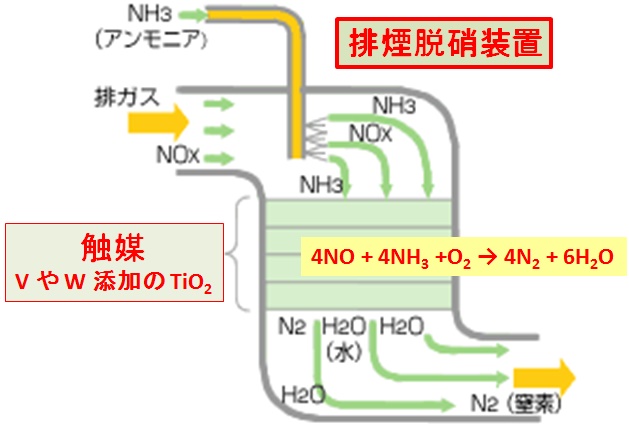
排煙脱硝装置の原理
元図出典:北陸電力(株)環境汚染防止対策
ページの先頭へ
硫黄酸化物( SOx )の発生
例えば,石炭には,酸化数 -2 の硫黄を有する有機硫黄化合物(スルフィド: R – S – R’ など),酸化数 -1 の硫黄の黄鉄鉱( FeS2 = Fe2+ + (S-S)2- ),酸化数 +6 の硫酸イオン( SO42- )などが含まれる。
硫黄を含む燃料の燃焼では,硫黄の酸化還元反応により,酸化数 +6 の三酸化硫黄(無水硫酸: SO3 ),酸化数 +4 の二酸化硫黄(亜硫酸ガス: SO2 ),酸化数 +2 の一酸化硫黄( SO )の混合物(総称して硫黄酸化物: SOx という)が発生する。
なお,一酸化硫黄は非常に不安定で,空気中の酸素と直ちに反応し二酸化硫黄になる。一般的に,燃焼排ガスの硫黄酸化物は
硫黄酸化物発生の反応例
酸化数 -2 の硫化水素や有機硫黄化合物の燃焼で酸化数 +4 の二酸化硫黄に酸化される。
2H2S(g) + 3O2(g) → 2H2O(g) + 2SO2(g)
酸化数 -1 の黄鉄鉱の燃焼で酸化数 +4 の二酸化硫黄に酸化される。
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
二酸化硫黄は,二酸化窒素との酸化還元反応で一酸化窒素と三酸化硫黄を,触媒のもと酸素との酸化還元反応で三酸化硫黄を生成する。
NO2 + SO2 → NO + SO3
2SO2 + O2 → 2SO3
水と接触した二酸化硫黄の反応(酸性雨の一因)
水に二酸化硫黄(酸化数 +4 )を通じると,水と反応し亜硫酸(イオン)(酸化数 +4 )を生成する。
SO2 + H2O ⇆ H+ + HSO3- , 2HSO3- ⇆ O2S-SO32- + H2O
亜硫酸(イオン)は溶存酸素(水に溶けた酸素)で酸化され硫酸(イオン)(酸化数 +6 )となる。
二酸化硫黄の空気酸化(スモッグ:硫酸エアロゾルの発生)
工業地帯の環境汚染として,中国や過去の日本などで問題となったスモッグの一因である。
大気中に排出された二酸化硫黄(酸化数 +4 )は,常温・常圧の清浄な空気中では安定に存在できるが,空気中に微粒子が浮遊していると,微粒子表面で酸素による酸化反応が促進され三酸化硫黄(酸化数 +6 )が生成し,水の吸着で硫酸を含む微小な液滴(硫酸エアロゾル)となる。
2SO2 + O2 → 2SO3
H2O + SO3 → H2SO4
ページの先頭へ