第四部:無機化学の基礎 生活と無機(環境問題)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,地域環境問題である光オキシダントに関連し, 【光化学オキシダントとは】, 【大気成分の光化学反応】, 【オゾン生成反応】, 【 VOC 対策とは】 に項目を分けて紹介する。
光化学オキシダントとは
成層圏に存在するオゾンは,オゾン層破壊とはで,波長の短い紫外線( UV-C )で酸素分子の解離により生成することを紹介した。
図「大気圏の構造とオゾン層の役割」で紹介したように,オゾン濃度は対流圏の地表近くでも高くなる。
対流圏のオゾンは,成層圏のオゾンとは異なる機構で生成している。問題となるのは,人為的な要因によるオゾンである。これは,公害の一種である光化学スモッグとして問題となった光化学オキシダント( photochemical oxidant )生成物の一つである。
光化学オキシダントとは,窒素酸化物と炭化水素とが光反応を起こし,生じたオゾンやパーオキシアシルナイトレート( PAN : CxHyO3NO2 )などの酸化性物質(オキシダント)の総称をいう。強力な酸化作用を持ち健康被害を引き起こす大気汚染物質として問題視される。
窒素酸化物について
窒素酸化物とは,酸化数 +1 の亜酸化窒素(一酸化二窒素)( N2O ),酸化数 +2 の一酸化窒素( NO ),酸化数 +3 の三酸化二窒素( N2O3 ),酸化数 +4 の二酸化窒素( NO2 ),四酸化二窒素( N2O4 ),酸化数 +5 の五酸化二窒素( N2O5 )などの総称である。亜酸化窒素(一酸化二窒素)( N2O )は,温室効果ガス,オゾン層破壊物質として,二酸化窒素( NO2 )は毒性が強く,環境汚染物質(酸性雨など)や光化学スモッグの原因物質として問題となる。
二酸化窒素( NO2 )は,水との接触で,次に示す自己酸化還元反応で,硝酸( HNO3 :酸化数 +5 )と亜硝酸( HNO2 :酸化数 +3 )が生成する。(酸性雨の一因)
2NO2 + H2O → HNO3 + HNO2
【参考】
光反応( photoreaction )
光のエネルギーにより引き起こされるさまざまな化学反応を総称して光反応という。
化学物質は,その物質に固有の電磁波(光)を吸収し,励起状態と呼ばれる反応活性の高い状態に変わる。その励起状態から緩和する過程で,結合,解離,発光,酸化,還元などの様々な化学変化が起きる。なお,光(電磁波)の影響を受けない反応を暗反応という。
身近には,大気成分の太陽光による光反応(光化学オキシダント),生化学分野の光合成における光反応(色素分子が光エネルギーを吸収し,物質の酸化還元)などを光化学反応( photochemical reaction ,light‐dependent reaction )と称する場合が多い。
ページの先頭へ
大気成分の光化学反応
成層圏では,「オゾン層破壊とは」で紹介したように,酸素分子が紫外線を吸収し,原子状の酸素となることで,オゾンが生成すること,オゾンが三体反応や紫外線の吸収で消滅することを紹介した。
この結果として,エネルギーの高い紫外線(波長の短い紫外線)が吸収され,対流圏(地表付近)まで届く電磁波(光)は,波長 300nm 以上,エネルギーに換算すると 398.8kJm-1 以下であることを示した。
対流圏の大気成分(含有量の多い順)と結合解離エネルギーの目安は次の通りである。
窒素 ( N2 ; 942kJmol-1 ) ,酸素 ( O2 ; 495kJmol-1 ) ,アルゴン ( Ar ) ,水 ( H2O ; H-OH 498kJmol-1 )
二酸化炭素 ( CO2 ; OC-O 531kJmol-1 ) ,ネオン ( Ne ) ,ヘリウム ( He ) ,メタン ( CH4 ; H3C-H 435kJmol-1 )
クリプトン ( Kr ),一酸化二窒素 ( N2O ; N-NO 481kJmol-1 ) ,水素 ( H2 ; 436kJmol-1 ) ,一酸化炭素 ( CO ; 1075kJmol-1 )
オゾン ( O3 ; OO-O 105kJmol-1 ) ,キセノン ( Xe ) ,二酸化窒素 ( NO2 ; ON-O 305 kJmol-1 )
よう素 ( I2 ; 151kJmol-1 ) ,二酸化硫黄 ( SO2 ; O-SO 523kJmol-1 ) ,アンモニア ( NH3 ; H-NH2 448kJmol-1 )
工業用溶剤類(結合解離エネルギーの幅が広い),フロン類,ハロン類,六フッ化硫黄である。
この中で,結合解離エネルギーが対流圏の光エネルギー hν(約 400kJmol-1 未満)で光分解できる物質は,オゾン ( O3 ) ,二酸化窒素 ( NO2 ) ,よう素 ( I2 ) ,及び溶剤類 ( R – R’ ) である。
NO2 + hν → O + NO
O3 + hν → O + O2
I2 + hν → I + I
R – R’ + hν → R + R’
生成物の一酸化窒素( NO )の結合解離エネルギーは 631.8kJmol-1 と酸素の結合エネルギーより大きく,光のエネルギーでは解離しない。
なお,結合・結合解離エネルギーは,解離熱を計測して求めるので,測定方法・精度の向上に伴い値が改訂される。ここで示した値は,化学便覧(第二版,第五版)などを参考にしたので,最新の値とは異なる場合がある。的確な数値が必要な場合は,別途調べることを推奨する。
【参考】
紫外線は,人間の健康や環境影響の観点から,一般的には,波長により 3種に分類される。
DNA の破壊などで突然変異を引き起こす波長 100~280nm の紫外線を UV-C ,皮膚がんや視力障碍を引き起こす波長 280~315nm の紫外線を UV-B ,植物の成長促進作用を有する波長 315~400nm の紫外線を UV-A に分類している。
ページの先頭へ
オゾン生成反応
酸素原子の発生
「オゾン層破壊とは」で紹介したように,成層圏でのオゾンは,触媒 M の関与する三体反応)で生成する。
O + O2 + M → M + O3 ,正味の反応: O + O2 → O3
反応に関わる酸素原子( O )は,波長の短い紫外線( UV-C )で励起された酸素分子( O2 )の解離で生成する。
しかし,対流圏では,前項で説明したように,波長の短い紫外線( UV-C ,UV-B の一部)が成層圏(オゾン層)で吸収され,到達する電磁波(光)の波長は 300 nm 以上である。この電磁波(光)エネルギー( 400kJmol-1 未満)では,結合解離エネルギー 495kJmol-1 の酸素分子( O2 )を解離できない。
従って,地表の電磁波エネルギーで励起・解離(光化学反応)され,酸素原子を生成できる反応は,オゾン( O3 → O2 + O )と二酸化窒素( NO2 → NO + O )となる。
酸素原子の供給がオゾンの解離のみの場合は,大気中のオゾン濃度は一定の値を超えることはない。従って,光化学オキシダントでのオゾン濃度増加は,人為的に大気に排出された二酸化窒素の影響であることが分かる。
大気中の二酸化窒素
大気中の二酸化窒素濃度の増加は,【燃焼排ガスの浄化】で紹介したように,化石燃料などの燃焼が原因となる。
生物由来の石炭などは,タンパク質を構成するアミノ酸など窒素を有する有機化合物を含む。これらの燃料が燃焼した場合に発生する窒素酸化物( NOx )をフューエル NOx といい,二酸化窒素( NO2 )が多く含まれる。
一方,窒素の含有が少ないガソリン,石油ガスや天然ガスの高温燃焼(内燃機関,ボイラなど)では,空気中の窒素の酸化に由来する窒素酸化物が生成される。この窒素酸化物( NOx )をサーマル NOx といい。一酸化窒素( NO )を主成分とする。
例: N2 + O2 → 2NO
石炭の利用が少ない日本などで,大気に排出される窒素酸化物の大部分は一酸化窒素( NO )である。この状態では,問題となるほどの光化学オキシダントの発生には至らない。
VOCの影響
しかし,大気中に揮発性有機化合物( VOC )が存在する場合に,次の反応例,模式図に示すように,遊離基(ラジカル)を生成し,一酸化窒素を酸化し二酸化窒素を生成する反応が連鎖的に進行し,オゾン,ペルオキシアシルナイトレートなどの酸化性物質(オキシダント)を生成し続けることになる。
反応例と模式図
RH + OH・ → R・ + H2O ,R・ + O2 → RO2・
RO2・ + NO → NO2 + RO・ ,NO2 + hν → O + NO
O + O2 → O3
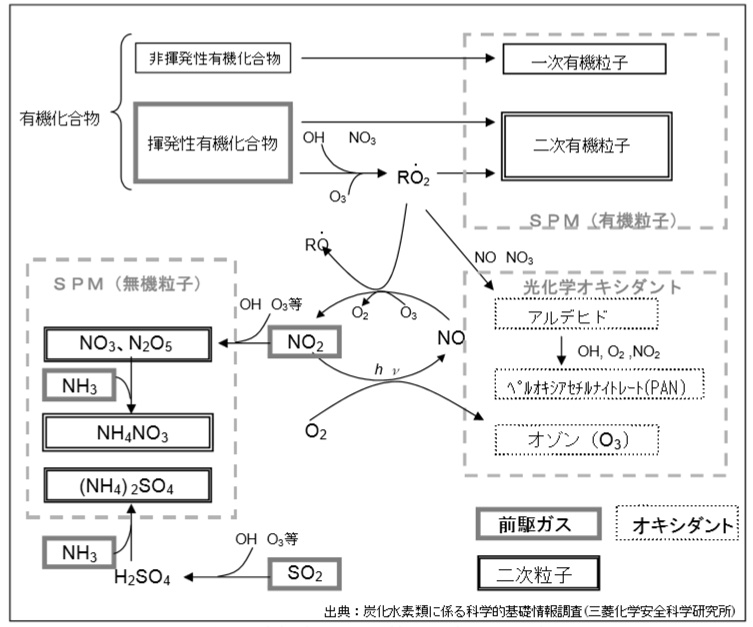
対流圏でのオゾン生成(光化学オキシダント)
出典:環境省・揮発性有機化合物対策 VOCと大気環境に関する資料 「SPMとオキシダントの生成メカニズム」
ページの先頭へ
VOC 対策とは
VOC は揮発性有機化合物(Volatile Organic Compounds)の略称で,塗料,印刷インキ,接着剤などに含まれるトルエン,キシレン,酢酸エチルなど直感的には「有機溶剤」といわれる揮発性の高い有機物質で,大気中の光化学反応により光化学スモッグを引き起こす原因物質の 1 つである。
日本の法における VOC の定義は次の通りである。
日本の法における VOC の定義は次の通りである。
大気汚染防止法第二条第四項
この法律において「揮発性有機化合物」とは,大気中に排出され,又は飛散した時に気体である有機化合物(浮遊粒子状物質及びオキシダントの生成の原因とならない物質として政令で定める物質を除く。)をいう。
揮発性の高い有機化合物ではあるが,法の「揮発性有機化合物」から除く物質を指定する政令は次の通りである。
大気汚染防止法施行令第二条第二項
法第二条第四項 の政令で定める物質は,次に掲げる物質とする。
メタン,クロロジフルオロメタン(別名 HCFC - 22 ),2-クロロ-1,1,1,2-テトラフルオロエタン(別名 HCFC – 124 ),1,1-ジクロロ-1-フルオロエタン(別名 HCFC – 141b ),1-クロロ-1,1-ジフルオロエタン(別名 HCFC – 142b ),3,3-ジクロロ-1,1,1,2,2-ペンタフルオロプロパン(別名 HCFC – 225ca ), 1,3-ジクロロ-1,1,2,2,3-ペンタフルオロプロパン(別名 HCFC – 225cb ),1,1,1,2,3,4,4,5,5,5-デカフルオロペンタン(別名 HCFC – 43110mee )
VOC 排出削減を目的とする法制度
VOC の削減を目的に,大気汚染防止法や PRTR 制度により排出量の把握及,排出削減及び飛散抑制を促す方策がとられている。
大気汚染防止法 第十七条第二項
揮発性有機化合物の排出及び飛散の抑制に関する施策その他の措置は,規定する揮発性有機化合物の排出の規制と事業者が自主的に行う揮発性有機化合物の排出及び飛散の抑制のための取組とを適切に組み合わせて,効果的な揮発性有機化合物の排出及び飛散の抑制を図ることを旨として,実施されなければならない。
PRTR 制度
人の健康や生態系に有害なおそれがある化学物質について,環境中への排出量及び廃棄物に含まれての移動量を事業者が自ら把握して行政庁に報告し,さらに行政庁は事業者からの報告や統計資料を用いた推計に基づき排出量・移動量を集計・公表する制度である。
この制度は,事業者の公表義務により,自主的な削減が促されることを期待した精度である。
VOC 排出源調査結果
VOC排出源の調査結果(下図)によると,排出源の大多数は,大きく変わらず,塗料(インキ),洗浄剤,接着剤である。なお図中の燃料(蒸発ガス)とは,燃料タンクや輸送中に漏れ出した量である。なお,VOC排出量の総量は,平成 12年度に比較し,平成 29年度には 1/2以下に減少している。
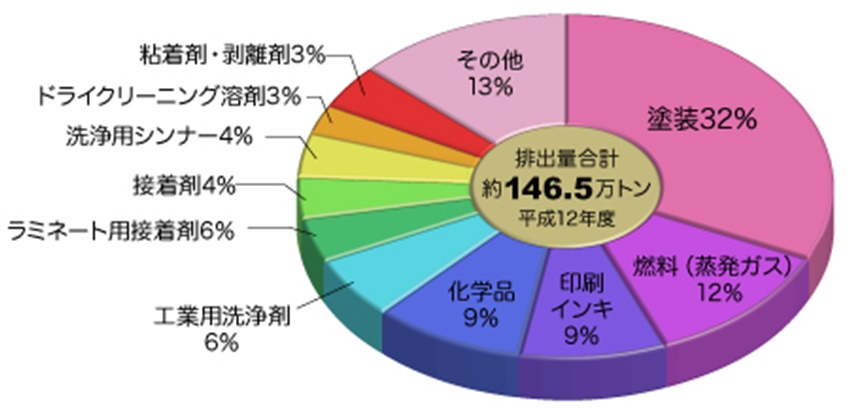
VOC 排出源(平成 12年度,平成 29年度)
出典:経済産業省 VOC 対策など
ページの先頭へ