第四部:無機化学の基礎 無機化学とは(基本)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,無機化学の基本となる光学的性質に関連し, 【吸光による励起】, 【吸光と発光の原理】, 【その他発光現象】 に項目を分けて紹介する。
吸光による励起
光(電磁波)を吸収した物質では,入射した光子( Photon :光量子ともいう)のエネルギーに相当する電子状態の遷移や運動エネルギーの増加が起こる。具体的には電子エネルギー,振動エネルギー,回転エネルギーが変化する。
光子のエネルギー E ( J )は,プランク定数 h( Js ),周波数ν( s-1 ),波長λ( m ),光の速度 c( m s-1 )とすると,
E = hν= h cλ-1
で与えられる。
なお,真空中の光速 c = 2.99792458×108 m s-1 ,プランク定数 h= 6.626070040×10-34 Js である。
電子遷移
エネルギー的に最低の状態を基底状態( ground state ),それよりも高い状態を励起状態( excited state )という。
光の吸収で基底状態から励起状態に上がることを遷移( transition )といい,基底状態の電子が 1 個励起状態に遷移することを電子遷移( electron transition )という。この状態を電子励起状態( electronic excited state )という。
電子遷移には,電子軌道間の遷移( s-p 遷移,d-s 遷移,d-d 遷移など),有機化合物の同定に用いられる分子軌道間の遷移(π-π*遷移,σ-σ*遷移など),錯体化学で扱われる電荷移動遷移( CT遷移),半導体や絶縁体の価電子帯と伝導帯間の遷移(バンド遷移)など様々の形態がある。
電子励起状態
電子励起状態をより具体的に説明すると,基底状態(スピン対の一重項状態: S0 )から電子 1 個の遷移で励起状態になることであるが,この場合には二通りある。
一つは電子がスピン状態を変えないで遷移し,基底状態と同じ一重項状態(励起一重項状態 excited singlet state といい,S1 , S2 などで表記)になる場合,
他は電子がスピン状態を反転して遷移し,スピン平行の状態になる場合で,三重項状態(最低三重項状態 lowest triplet state といい,T1 , T2 などで表記)になる場合である。
電子遷移では,励起一重項状態と三重項状態はセットで存在する。例えば,S1 と T1 ,S2 と T2 などである。この場合に,三重項状態の方がエネルギー的に必ず低くなる。。
【参考】
多重度( multiplicity )
多重度は,スピン角運動量 S を用いて,“ 2S+1 ”と定義される。スピン角運動量 S は,(不対電子の数)/2 で表される。
すなわち,全ての電子が対のとき S = 0 /2 で,多重度は 2×0 + 1 = 1 となり,一重項( singlet )と呼ばれる。電子遷移で不対電子が 2 個となる場合は,S = 1 となり,多重度は 3 で三重項( triplet )と呼ばれる。
ページの先頭へ
吸光と発光の原理
吸光の基本
電子遷移では,基底状態(一重項)の電子が励起され,励起一重項状態と三重項状態のセットが生じることを紹介した。状態間の電子の遷移には,参考に示す許容遷移か禁制遷移かで,遷移し易さに差が生じる。
一般的に,スピン禁制遷移による吸収では,光を吸収したとしてもその励起状態に存在する分子の数が無視できるほど小さい。
従って,光吸収での励起状態としては,励起一重項状態であり,三重項状態は励起一重項状態を経由して生じると考えるのが通常である。
多くの物質では,遠赤外やマイクロ波のようなエネルギーが低い電磁波の吸収で回転状態のみが変化する。
中波長赤外,近赤外程度では,振動,回転の状態が変化する。可視光や紫外のなどのエネルギ―の高い光吸収では電子,振動,回転の状態が変化する。
従って,全ての電子状態には物質の振動運動に伴い,振動量子数 v( 0, 1, 2, ・・・)に対応する振動準位( vibrational level )と呼ばれるエネルギー準位がさらにある。
参考
許容遷移( allowed transition )と禁制遷移( forbidden transition )
2 つの状態間の電子遷移が制約を受けない場合を許容遷移,制約を受ける場合を禁制遷移という。
同じスピンを持った状態間の電子遷移はスピン許容遷移といい,異なるスピンを持った状態間の電子遷移はスピン禁制遷移といい,厳しい制約を受ける。
例えば励起一重項状態から基底状態( S1 → S0 )の遷移は許容遷移であるが,励起一重項状態から三重項状態( S1 → T1 )や三重項状態から基底状態( T1 → S0 )の遷移は禁制遷移である。
スピン許容遷移は,強度が強く,大きいモル吸光係数を取れるが,スピン禁制遷移は強度が非常に弱く,小さいモル吸光係数となる。
発光の基本
電子遷移が可能な波長(エネルギー)の光を照射した場合に,物質の光吸収と発光は,下図に示す電子状態の変化で説明される。
光吸収による励起は,許容遷移である基底状態( S0 )から励起一重項状態( S1 )の各振動準位への遷移である。
蛍光
励起一重項状態に遷移した電子は,熱エネルギーなどを放出し,振動準位の低い状態に遷移するなどの過程を経て,光を発しながら許容遷移である基底状態の各振動準位へ遷移する。この発光現象を蛍光という。
下図右に示した各状態変化とエネルギーの関係で分かるように,蛍光スペクトルは,光吸収スペクトルよりも低エネルギー(長波長)側に現れる。多くの蛍光物質では,励起状態と基底状態の振動準位の間隔が類似しているため,蛍光スペクトルと光吸収スペクトルが鏡に映したような形を与える。これを鏡像関係という。
りん光
励起一重項状態と三重項状態( T1 ),三重項状態と基底状態間の遷移は,禁制遷移のため多くの制約を受け,結果として時間をかけて基底状態に遷移する。従って,励起光を遮断した後も光を発する寿命の長い発光となる。これをりん光といい蛍光とは区別される。
ただし,寿命の長い発光の中には,三重項状態の電子が励起一重項状態に戻り基底状態に遷移する際の光もある。これはりん光とは区別して遅延蛍光と呼ぶ。
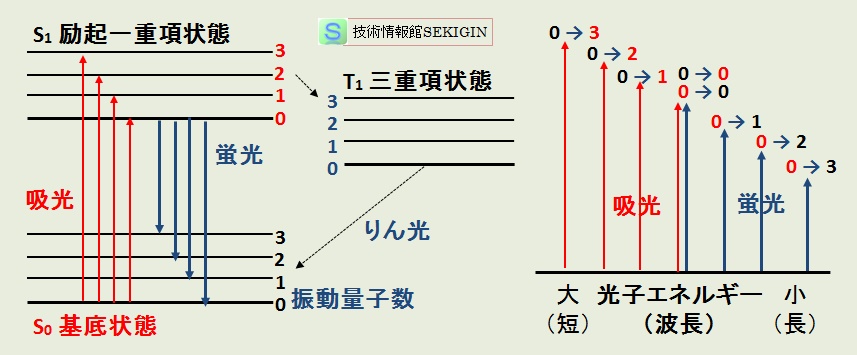
光吸収と蛍光・りん光の関係(模式図)
ページの先頭へ
その他発光現象
光エネルギーで励起されて発光する現象をフォトルミネセンス( Photoluminescence )という。光以外のエネルギーを吸収して励起し,光を発する現象には,電子線照射にる発光(カソードルミネセンス),発光ダイオードなど電圧による励起による発光(エレクトロルミネセンス),音響エネルギーによる発光(ソノルミネセンス),化学反応エネルギーを用いた発光(化学発光,ケミルミネセンス),酵素反応を用いた発光(生物発光,バイオルミネセンス),熱エネルギーで励起する発光(熱ルミネセンス)などがある。
炎色反応( flame reaction )
最も身近な花火の発光原理で,熱エネルギーで励起した原子の発光現象である。金属元素特有の光(複数の波長の光)を発するので,発光分光など金属の定性・定量分析に利用されている。視認される色は複数の光の混合色となる。次には,J. W. ロビンソン著「機器分析‐基礎と応用‐」などに紹介される主な金属元素の炎色反応(色,主な波長)を紹介する。
アルカリ金属:リチウム Li(深紅色 670.8 nm ),ナトリウム Na(黄色 589.6 , 589 nm ),カリウム K(紫色 404.4 , 760 nm ),ルビジウム Rb(深赤色 780 nm ),セシウム Cs(青紫色 455.5 nm )
アルカリ土類金属:カルシウム Ca(橙赤色 422.7 , 554 , 662 nm ),ストロンチウム Sr(深紅色 460.7 nm ),バリウム Ba(黄緑色 455.5 , 553.6 nm )
その他金属:銅 Cu(青緑色),ホウ素 B(緑色),ガリウム Ga(青色),タリウム Tl(淡緑色),スズ Sn(淡青色)インジウム In(藍色)
なお,炎の色観察では,人の汗などに含まれるナトリウムの試験結果への影響を排除するため,定性化学分析では,コバルトガラスを通して観察する方法がとられる。この場合,裸眼で観察した色とは異なるが,より正確な評価が可能になる。

炎色反応
写真出典:ようこそ化学実験室へ
ページの先頭へ