第四部:無機化学の基礎 金属元素(典型元素)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,金属元素(典型元素)の共通特性として, 【金属とは】, 【典型元素の特徴】, 【典型元素の金属とは】 に項目を分けて紹介する。
金属とは
金属( metal )
明確な定義はないが,固体状態で,次の性質を示すものの総称として用いるのが一般的である。
① 塑性変形が容易で,展延加工ができる。
② 不透明で輝くような金属光沢がある。
③ 電気および熱をよく伝導する。
④ 水溶液中で 陽イオン(カチオン,cation , positive ion )になる。
なお,水銀のみは,常温・常圧の下で液体である。一般には,比重 4~5より重いものを重金属,軽いものを軽金属という。
金属結合( metallic bond )
金属で見られる結合は,電子対を共有する結合の他に,いくつかの電子を出して陽イオン(正電荷を持つ金属の原子核)と,自由電子(全体に広がる負電荷)とを形成する金属結合からなる。
液体及び固体の金属は,電子を放出した陽イオンの間を自由電子が動き回り,これらの間に働くクーロン力(静電気力,静電引力)で結び付けられている。
【参考】
塑性( plasticity )
力を加えて変形(ひずみ)した物質が,力を除去しても元に戻らない性質(変形のまま)。
弾性と塑性
力を加えて変形(ひずみ)した物質が,力の除去で元の形に戻ろうとする性質を弾性(elasticity)というが,元に戻らない性質(変形のまま)を塑性という。
延性( ductility )
物質に引張り力を加えた時の変形する能力をいう。一般的には,針金状に延ばせる能力をいう場合が多い。
金属の延性は,金( Au )>銀( Ag )>白金( Pt )>鉄( Fe )>ニッケル( Ni )>銅( Cu )>アルミニウム( Al )>亜鉛( Zn )>スズ( Sn )>鉛( Pb )の順にである。鋼(鉄の合金)の延性は,合金成分の種類と量(特に炭素)で大きく変わる。
展性( malleability )
物質に圧縮力を加えた時の変形する能力をいう。工業的な作業工程の鍛造や圧延で薄いシート状に成形できる能力をいう場合が多い。そのため展性を可鍛性(かたんせい)とも呼ぶ。
金属の展性は,金( Au )>銀( Ag )>鉛( Pb )>銅( Cu )>アルミニウム( Al )>スズ( Sn )>白金( Pt )>亜鉛( Zn )>鉄( Fe )>ニッケル( Ni )の順である。
金属光沢
自由電子は,可視光を含めた広い波長範囲の電磁波を反射(種々の波長の光を吸収し,再放出)できる。これにより,金属固有の光沢が生まれる。
自由電子( free electron )
自由電子とは,束縛を受けていない電子をいう。即ち,特定の原子核の近傍に留まらず結晶全体に非局在化している電子である。
自由電子の存在が,電気や熱の高い伝導性の要因の一つとなっている。このため,自由電子は伝導電子とも呼ばれる。
ページの先頭へ
典型元素の特徴
典型元素 ( typical element )
遷移元素以外の元素(周期表の 1族,2族と 12族から 18族)の総称で,各族で縦の類似性が大きい。これが,典型の語源で,周期表の特徴をよくあらわしている。
典型元素の特徴は,周期表の族ごとに特有の性質を示し,13族を除きオクテット則に従う場合が多く,族が小さいほど陽イオンになりやすく,大きいほど( 18族を除く)陰イオンになりやすい。
また,元素の酸化数については,アベックの規則に従い,短周期の族番号を N(例えば,長周期の 13 族は,短周期で 3A 族なので,N = 3 となる)とすると,最大の正の酸化数は + N ,最小の負の酸化数は ‐( 8‐N ) の値をとる。
典型元素の単体においては周期が小さいほど共有結合性が強く,周期が大きいほど金属結合性が強い。この典型元素の性質は 1族元素においては水素のみが共有結合性を示し,他は金属結合性を示すといったあらわれ方をしている
【参考】
オクテット則( octet rule )
原子の最外殻電子の数が 8 個あると化合物やイオンが安定に存在するという経験則。周期表の第二周期の元素,第三周期のアルカリ金属、アルカリ土類金属までにしか適用できないが,多くの有機化合物に適用できる便利な規則である。
【原子の構造】で紹介したように,最外核電子 8 個の状態は,化学的に安定な希ガス類( 18 族)と同じで,原子はこの電子配置を持とうとしてイオン化しやすい。
アベックの規則( Abegg's rule )
1904年ドイツの物理化学者アベック( Richard Abegg )によって1904 年に提唱された原子価に関する指摘で,正常原子価および逆原子価の最高値の絶対値の和はつねに 8 になるというものである。
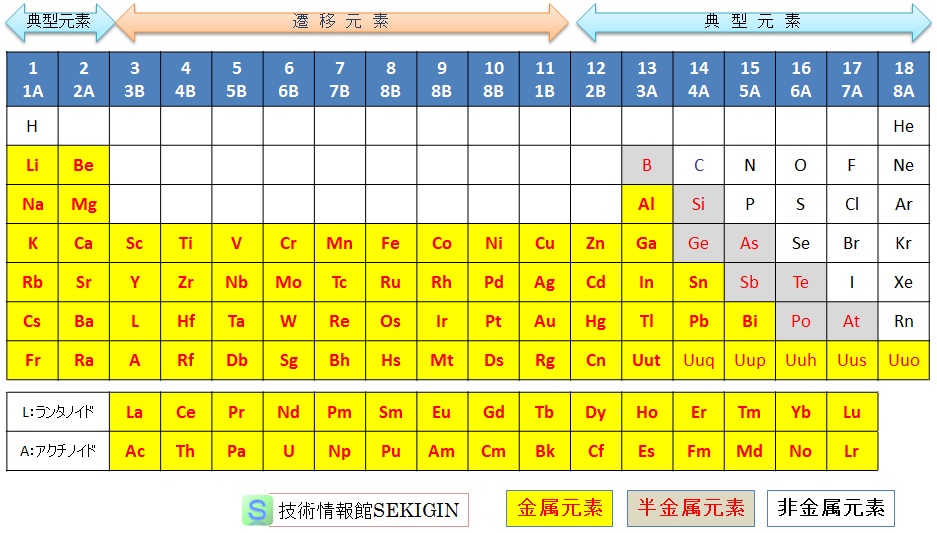
周期表(2015年)
ページの先頭へ
典型元素の金属とは
金属元素として分類される元素には,遷移元素と典型元素に分けられる。
高等学校教育など一般的に扱われる典型元素の金属元素には,上図の周期表における半金属元素を金属性の多寡により非金属と金属元素に分られる。
典型元素に分類される金属元素は,高等学校等での分類に従い示すと,
周期表 1族
水素( H )を除くリチウム( Li ),ナトリウム( Na ),カリウム( K ),ルビジウム( Rb ),セシウム( Cs ),フランシウム( Fr )
周期表 2族
ベリリウム( Be ),マグネシウム( Mg ),カルシウム( Ca ),ストロンチウム( Sr ),バリウム( Ba ),ラジウム( Ra )
周期表 12族
亜鉛( Zn ),カドミウム( Cd ),水銀( Hg ),コペルニシウム( Cn )
周期表 13族
ホウ素( B )を除くアルミニウム( Al ),ガリウム( Ga ),インジウム( In ),タリウム( Tl ),ウンウントリウム( Uut )
周期表 14族
炭素( C ),ケイ素( Si )を除くゲルマニウム( Ge ),スズ( Sn ),鉛( Pb ),フレロピウム( Fl )
周期表 15族
窒素( N ),リン( P ),ヒ素( As )を除くアンチモン( Sb ),ビスマス( Bi ),ウンウンペンチウム( Uup )
周期表 16族
酸素( O ),硫黄( S ),セレン( Se ),テルル( Te )を除くポロニウム( Po ),リバモリウム( Lv )
となる。
ページの先頭へ