第一部:化学と物質構造・イオン結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電子親和力について,【電子親和力とは】, 【電子親和力を求める方法】, 【電子親和力の例】 に項目を分けて紹介する。
電子親和力とは
イオンのなり易さ,即ち,原子から電子を引きはがすのに必要なエネルギーについては,定義の違いで① イオン化エネルギー(ionization energy)及び電子親和力( electron affinity ) ,② 仕事関数(work function),③ 酸化還元電位( redox potential )に分けられる。
電子親和力( electron affinity )は,原子間の結合力や分子中の電子の挙動を考えるうえで,イオン化エネルギーと共に重要な量である。
電子親和力は,1個の原子(又は分子)に電子を付加する際に放出するエネルギーである。放出するエネルギーが大きいほど電子を受けとった状態(陰イオン)が安定であることを意味する。
なお,エネルギーがマイナスの場合は,電子を受け取るためにエネルギーが必要であることを意味し,陰イオンになり難いことを意味する。
すなわち,電子親和力の大きい原子ほど,陰イオンの状態が安定であるから,陰イオンになり易く,陰性が強いといえる。
【参考】
イオン化エネルギー( ionization energy )
電離エネルギー,イオン化ポテンシャルとも言い,気体状態の単原子(又は基底状態の分子)から原子やイオンなどから電子を取り去るのに要するエネルギー,すなわち,取りだされた電子の結びつきの強さの目安で,エネルギーが小さいほど陽イオンになり易く,陽性が強いという。
ページのトップへ
電子親和力を求める方法
直接求める方法と間接的に計算する方法が多数ある。電子親和力は,測定方法,計算方法により値が異なるので,参考にした文献や書籍によっては値が異なることも多い。
直接求める方法の例
測定しようとする原子(又は分子)の陰イオンに光を照射し,そのイオンから電子を分離する電子離脱法( electron detachment ),原子(又は分子)が陰イオンになるときの放射光を測定する電子捕獲法( electron capture )などがある。
間接的に求める方法の例
例として,ボルン・ハーバーサイクルによる計算を紹介する。このサイクルでは,結晶を気相の陽イオンと陰イオンに分けるのに必要な格子エネルギー( U0 ),陽イオンとなった原子(金属)が最外殻電子を放出し陽イオンになるイオン化エネルギー( I ),陽イオンになった原子の昇華熱( S ),陰イオンとなった元素の分子の解離エネルギー( D ),イオン結晶生成時の生成熱( Q )を用い,陰イオンとなった原子が電子を受け取るための電子親和力( E )は,次の関係から求めることができる。
U0 ‐ Q ‐ S ‐ I ‐ D/2 + E = 0
【参考】
ボルン・ハーバーサイクル(Born-Haber cycle)
ドイツの理論物理学者ボルン( Max Born )とドイツ出身の物理化学者ハーバー( Fritz Haber )とが互いに独立に,イオン性結晶の格子エネルギーを求めるための循環過程。
単体から出発して,原子化,イオン化を経由してイオン結晶をつくる場合と,直接反応でつくる場合の反応エネルギーはヘスの法則に従い等しいことを用いて,格子エネルギーを差として求めることが可能となる。
ヘスの法則( Hess's law )
「化学反応での反応熱は,反応前後の状態のみで決まり,反応経路によらず一定である」や「化学反応のエンタルピー変化は,反応経路によらず一定」と表現される。
格子エネルギー( lattice energy )
気体状態から固体結晶になるときの凝集エネルギーである。
イオン結晶の格子エネルギーは,イオン化エネルギー,電子親和力,成分元素の原子化熱,生成熱からボルン・ハーバーサイクルを用いて求めることができる。
昇華熱( heat of sublimation )
固体が直接気化するとき吸収する熱。固体の昇華熱は,同じ温度,同じ物質の融解熱と蒸発熱の和に等しい。
昇華( sublimation )
元素や化合物が,液体を経ずに固体から気体,気体から固体へと相転移する現象。
解離エネルギー( dissociation energy )
一つの物質が二つ以上の物質に解離するのに必要なエネルギー。
生成熱( heat of formation )
1 mol の化合物がそれを構成する元素から生成されるときのエンタルピー増加をいう。
ページのトップへ
電子親和力の例
参考表には,周期表の第 4周期までの電子親和力の例を示す。表には,同様に原子の電子状態の評価に用いられるイオン化エネルギーも併せて記した。
フッ素,塩素などハロゲン元素は,他の元素に比較し,電子親和力が飛び抜けて大きく,陰イオンになり易いことが分かる。
希ガス元素(ヘリウム,アルゴンなど),窒素などの電子親和力がマイナスの原子は,電子を受け取ってエネルギーを放出することが無い。すなわち,通常の条件では陰イオンになり難いことが分かる。
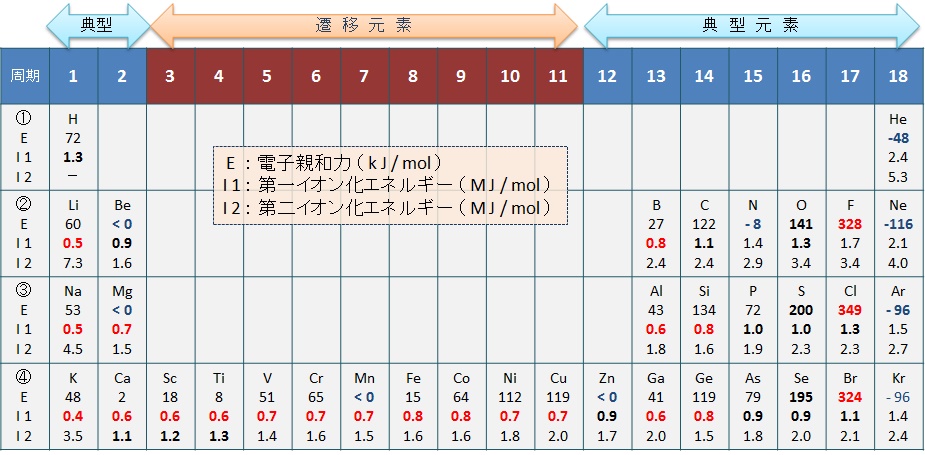
参考表 電子親和力( E )とイオン化エネルギー( I ): 単位, E : kJ/mol,I : MJ/mol
ページの先頭へ