第四部:無機化学の基礎 金属元素(典型元素)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,周期表 14,15族の金属元素について, 【周期表 14,15,16属について】, 【14族:ゲルマニウム】, 【14族:スズ】, 【14族:鉛】, 【15族:アンチモン,ビスマス】, 【14,15,16族:放射性元素について】 に項目を分けて紹介する。
周期表 14,15,16属について
周期表 14族の炭素( C ),ケイ素( Si )は非金属元素で,金属元素はゲルマニウム( Ge ),錫( Sn ),鉛( Pb ),フレロビウム( Fl )である。
周期表 15族の窒素( N ),リン( P ),ヒ素( As )は非金属元素で,アンチモン( Sb ),ビスマス( Bi ),モスコビウム( Mc )が金属元素である。
周期表 16族の酸素( O ),硫黄( P ),セレン( Se ),テルル( Te )は非金属元素で,金属元素はポロニウム( Po ),リバモリウム( Lv )である。
なお,太字は実用される元素である。また,ゲルマニウム,アンチモン,ビスマスは,レアメタルに分類される元素である。
周期表 14族のフレロビウム,15族のモスコビウム,16族のポロニウムとリバモリウムは,実用例がほとんどない放射性物質である。
次には,実用される主な元素の基礎物性を紹介する。なお,比較のため,身近な金属単体として,アルミニウム,鉄,銅の値も併記する。
なお,ポーリングの電気陰性度,イオン化エネルギーは別途紹介している。なお,これらの値は,算出に用いる解離エネルギー値や結合エネルギー値の改訂で変わるので,紹介した値は最新値ではなく,引用文献での値である。
| 元素記号 | Ge | Sn | Sb | Pb | Bi | Al | Fe | Cu |
|---|---|---|---|---|---|---|---|---|
| 原子番号 | 32 | 50 | 51 | 82 | 83 | 13 | 26 | 29 |
| 原子量 | 72.63 | 118.71 | 121.76 | 207.2 | 208.98 | 26.98 | 55.85 | 63.55 |
| 融点(℃) | 938.25 | 231.93 | 630.63 | 327.46 | 271.5 | 660.3 | 1538 | 1084 |
| 密度(×106 gm-3) | 5.323 | 7.365 | 6.697 | 11.34* | 9.78* | 2.70 | 7.87 | 8.94 |
| 結晶構造 | *1 | *2 | *3 | fcc | *3 | fcc | bcc | fcc |
| 格子定数(×10-10 m) | 5.657 | *2 | 4.507 | 4.951 | 4.746 | 4.0496 | 2.867 | 3.615 |
| モース硬度 | 6.0 | 1.5 | 3.0 | 1.5 | 2.25 | 2.8 | 4.0 | 3.0 |
| 電気抵抗(×10-8 Ωm:20℃) | 108 | 11.5 | 41.7 | 20.8 | 129 | 2.82 | 9.61 | 1.68 |
| 熱伝導率( W m-1K-1:300K) | 60.2 | 66.8 | 24.4 | 35.3 | 7.97 | 237 | 80.4 | 401 |
備考: fcc (立方最密充填,面心立方格子),bcc (体心立方格子)
*1: ダイヤモンド構造( 4 配位),*2: βスズ構造(正方晶)格子定数( 5.820 , 3.175),*3: 三方晶系
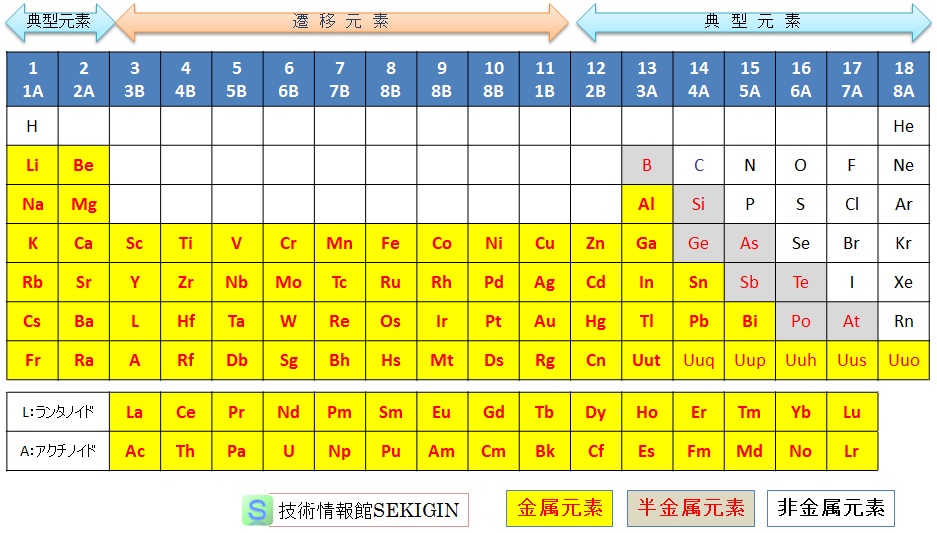
周期表(2015年)
ページの先頭へ
14族:ゲルマニウム( Ge )
天然には,硫ゲルマン銀鉱( Ag8GeS6 :硫ゲルマニウム銀鉱,アージロード鉱ともいう),ゲルマン鉱( Cu13Fe2Ge2S16 )などの鉱物として存在するが,工業的には亜鉛や銅の精錬における副産物として得られる。
ゲルマニウム単体は,ダイヤモンド構造を持ち硬い銀光沢を持つ物質である。高等学校教育など一般的な分類では,金属として扱われている。
しかし,単体の電気抵抗率が 1 Ωm程度と,他の金属単体に比較して抵抗率が著しく大きい。通常の金属とは異なり,温度を上げると,最外殻電子の遊離で自由電子が増え,電気抵抗が指数関数的に減少するなど,非金属と金属の境界に位置する物質(半導体)である。
ゲルマニウム単体は,水と同様に液体の密度(融点の液体 5.6×106 gm-3 )が固体の密度(室温付近 5.323×106 gm-3 )より大きくなる特性がある。この特性を示す元素単体は,ケイ素,ゲルマニウム,ガリウム,ビスマス,アンチモンに限られる。
反応性
ゲルマニウム単体は,常温・常圧の水中,空気中では安定に存在する。高温の空気中では,酸化ゲルマニウム( GeO , GeO2 )になる。
常温では,塩酸,希硫酸とは反応しないが,酸化力のある酸(熱濃硫酸,濃硝酸)に溶解し二酸化硫黄を発生する。硝酸を作用させると白色の酸化物となる。酸化物は,希硫酸には溶けないが,塩酸には容易に溶けて二塩化物をつくる。
ゲルマニウム単体を塩素中で加熱することで,気体状の四塩化物(四塩化ゲルマニウム: )が得られる。四塩化ゲルマニウムは,融点 -49.5 ℃,沸点 86 ℃,比重( 20 ℃)1.887と常温では重い液体である。
用途例
初期のトランジスタにはゲルマニウムが使われ,ケイ素(シリコン)が登場するまでは主流だった。現在でも,ダイオードや光検出器,γ線検出器(半導体検出器)などに用いられている。
四塩化ゲルマニウム( GeCl4 )は,純粋なゲルマニウムを得る原料,光ファイバー製造の原材料として用いられる。
ゲルマニウムの単体や酸化物は,波長 2~20μmの光(短波長赤外線~遠赤外線)の赤外線の透過率が高く,赤外域で高い屈折率(約 n = 4)を示す。また,石英を用いたレンズにゲルマニウムの添加で屈折率が上がる。赤外線に対する特性を活用した光学用途(ミラー,窓材)に多用される。
ガラス製光ファイバー製法の一例である MCDV 法では,酸素ガスで気化した四塩化ケイ素( SiCl4 ),四塩化ゲルマニウム( GeCl4 ),塩化ホスホリル( POCl3 )の混合ガスを石英ガラス管内に送り込み,1600~1800℃に加熱し生成したガラス微粒子の集合体(スート:Soot )を積層させて作る。
二酸化ゲルマニウム( GeO2 )は,蛍光灯,ブラウン管などの蛍光体 ,ボトル用PET 樹脂製造の触媒などに用いられている。
【参考】
屈折率( refractive index )
真空中の光速を物質中の光速で割った値で,真空を 1とした物質固有の値を絶対屈折率,2 つの物質の絶対屈折率の比を相対屈折率と呼ぶ。レンズは,屈折率の大きい材料を用いると薄くて済む。
全反射率( total reflection )
屈折率が大きい媒質から小さい媒質に光が入るとき,入射光が境界面を透過せずすべて反射する現象を指す。入射角がある一定の角度以上で全反射がおこる。この角度を臨界角という。臨界角Θm は,スネルの法則を用いて
sin Θm = nA /nB ここで,nA , nB は媒質 A ,媒質 B の絶対屈折率。
ページの先頭へ
14族:スズ( Sn )
スズの鉱石鉱物には,合金の元素鉱物(スチスタアイト SbSn ),硫化鉱物(ヘルツェンベルグ鉱 SnS ,ベルンド鉱 SnS2 など),酸化鉱物(錫石 SnO2 ),珪酸塩鉱物(マラヤ石 CaSnSiO5 )など多数あるが,スズ単体を得るために利用される鉱石は錫石( SnO2 )のみである。
スズ単体の結晶構造は,温度で変わり,常温では正方晶(格子定数 5.820 , 3.175 )が安定ある。この構造のスズは,βスズ(白色スズ)といわれる。161 ℃以上では斜方晶のγスズが,13 ℃以下では,ダイヤモンド状の構造を持つαスズ(格子定数 5.489 )が安定となる。
温度により,結晶構造が変わることは,すなわち単体の密度が変わることを意味する。それぞれの密度は,αスズ 5.77×106 gm-3 ,βスズ 7.365×106 gm-3 ,γスズ 6.52×106 gm-3 と低温,高温で密度が減る。
実際に,βスズを -10 ℃以下で長期間冷却すると実用上問題(ひび割れなど)となるほどの結晶構造変化(変態)が起こる。この現象をスズペストという。
スズ単体を勢い良く曲げると,音が発生する。これをスズ鳴き( tin cry )といい,結晶構造が双晶に変化(変形双晶)することに起因した音響放出( AE : acoustic emission )である。同様の現象はニオブ,インジウム,亜鉛,ガリウムでも起きる。
反応性
スズ単体は,中性の水や常温の空気中で,酸素や水と反応し表面が不動態被膜で覆われ,その後の酸化還元反応が抑制される。スズの不動態被膜については,酸化皮膜の厚み 5 nm までは時間に対し直線的に成長するが,その後は 1/4 乗則で 15 nm 程度まで成長し飽和することが報告1)されている。
文献 1):鍋田佑也・玉井輝雄・斉藤寧・澤田滋・飯田和生・服部康博:「錫(Sn)めっき接触面での酸化皮膜の成長と接触抵抗特性 ~ エリプソメトリによる研究 ~」,信学技報,vol. 108 , no. 466, pp. 49-52 ( 2009 )
不動態被膜を破壊する塩酸には水素を発生して溶けるが,希硫酸や有機酸に対しては,反応速度が小さい。
酸化性のある熱濃硫酸には硫酸スズ(Ⅱ)となり溶け,希硝酸には可溶性物質を生じて溶けるが,濃硝酸では不溶性の水和した酸化スズ(Ⅳ)を生じ,スズ単体の表面に付着し反応の進行が遅くなる。
スズ単体は,アルミニウムと同様に塩基にも溶解する両性金属である。
Sn + 2HCl ( H+ + Cl- ) → SnCl2 ( Sn2+ + 2Cl- ) + H2↑
Sn + 2NaOH ( Na+ + OH- ) + 4H2O → Na2 [Sn(OH)6] ( 2Na+ + Sn(OH)62- ) + H2↑
用途例
金属素材としての用途
スズ単体や合金成分として古来より用いられてきた。スズ単体としては,茶器,酒器,食器,銅鍋のめっき,めっき鋼板(ブリキ,缶詰,玩具),スズ箔として用いられている。間接的な利用として,融点が低いことを利用し,フロートガラス製造で使われている。
スズを含む合金には,青銅,パイプオルガンのパイプ,活字合金,はんだ( PbSn 系,SnCu 系,SnAgCu 系,SnZnBi 系,SuZnAl 系),軸受に用いられるバビットメタル(銅およびアンチモンとの合金),低融点合金( 融点 70℃のウッドメタル Bi 50% , Pb 26.7% , Sn 13.3% , Cd 10% ,融点 -19℃のガリンスタン Ga 68.5% , In 21.5% , Sn 10% )にも用いられている。
化合物としての用途例
スズ化合物としては,漆器作りなどの軟らかい材料の研磨材として酸化スズ( SnO2 )が,透明な配線膜として酸化インジウム( In2O3 )と酸化スズの混合物が,殺菌,殺虫を目的に各種有機スズが用いられている。海洋生物付着防止目的(防汚)に船底や漁具に有機スズを添加した防汚塗料(海洋生物への影響があり,日本など使用禁止の国が多い)用いられていた。
ページの先頭へ
14族:鉛( Pb )
古くから使われてきた代表的な重金属である。まれに自然鉛として金属状態で産出されるが,多くは硫化物の方鉛鉱( PbS )から産出される。他に,黒鉱鉱床(銅,亜鉛などと共存),硫酸塩の硫酸鉛鉱,炭酸塩の白鉛鉱,クロム酸塩の紅鉛鉱としても産出する。
ウランやトリウムなどの鉛よりも原子番号の大きな放射性元素が壊変し,最終的には鉛の同位体を生じる(放射性系列)。
核崩壊の親核種により,生成する鉛の同位体が異なるため,鉛の同位体組成は産地で異なる。これを利用し,出土品や汚染物質の起源を同位体組成から推定することができる。
反応性
鉛単体は,空気中ですぐに黒ずむが酸素,水,二酸化炭素,硫黄酸化物などとの反応生成物(酸化鉛,炭酸塩,硫酸塩など)で覆われその後の腐食を抑制(不動態化)するため長期間安定して存在できる。
水との接触では,酸素を含む純水中では溶解が進むが,水道水等の中性水中では,難溶性の炭酸塩や重炭酸塩で表面が覆われ,酸化の進行が抑制される。
希塩酸や希硫酸に対しては,表面が難溶性の塩化鉛( PbCl2 )や硫酸鉛( PbSO4)で覆われ,その後の反応が抑制される。
しかし,硝酸塩( Pb(NO3)2 )は溶解性が高く表面に沈着しないので,硝酸には容易に溶解する。酢酸鉛も水可溶のため,酢酸水溶液で溶解する。
塩基に浸漬された鉛の表面は,浸漬初期には,塩基に浸漬する以前に表面を覆っていた難溶性の鉛酸化物( PbO ),及び塩基と接触することで生じた難溶性の水酸化鉛( Pb(OH)2 )などで覆われる。
その後に,これらの化合物は,溶液中に存在する多量の水酸化物イオンにより,次に示すテトラヒドロキソ鉛(Ⅱ)酸イオン( [Pb(OH)4]2- )となり溶解する。このため,鉛は“過剰の塩基に溶解”などと表現される両性金属である。
Pb(OH)2 + 2NaOH → 2Na+ + [Pb(OH)4]2-
PbO + 2NaOH + H2O → 2Na+ + [Pb(OH)4]2-
用途例
鉛の用途は,鉛蓄電池の電極,金属の快削性向上のための合金成分,鉛ガラス(光学レンズやクリスタルガラス),美術工芸品(例えばステンドグラスの縁),防音・制振シートや免震用ダンパー,銃弾,電子材料(チタン酸鉛)などである。比重が大きいので放射線遮蔽材(鉛ガラスや鉛シート)としても用いられる。
なお,かつては水道管,はんだ,防せい顔料(四酸化三鉛: Pb3O4 )白色顔料(二酸化鉛: PbO2 ),黄色顔料(クロム酸鉛: PbCrO4 )などに鉛が大量に利用されていたが,鉛の生物に対しての毒性と蓄積性のため,人と直接接触する材料への使用制限が進み,無鉛化の技術開発が進んでいる。
電気通信分野では,欧州連合の RoHS (電気電子機器に含まれる特定有害物質の使用制限に関する指令)にみられるように,電気回路のはんだなどで鉛フリーのもへの転換が進んでいる。
ページの先頭へ
15族:アンチモン( Sb ),ビスマス( Bi )
アンチモン( Sb )
アンチモンを含む主な鉱石に輝安鉱( Sb2S3 ),ベルチェ鉱( FeSb2S4 )などがあるが,工業的には,銀,銅,鉛などの製錬の際の副産物として,アンチモン単体や鉛・アンチモン合金として得られる。
単体は,半金属として扱われる銀白色の金属光沢のある固体で,淡青色(淡紫色)炎色反応を示すレアメタルに分類される元素である。
用途例
人体に対して毒性の疑いがあり,素材の代替開発が進み使用が控えられる傾向にある。
これまでは,活字合金,鉛蓄電池(バッテリー)の電極材料,ハンダ合金の材料,アルミニウム合金への添加物,軸受合金,半導体材料への添加物,ポリエステル製造の触媒,顔料(三酸化アンチモン,Ti – Cr – Sb 系クロムチタンイエロー),難燃助剤(三酸化アンチモン,五酸化アンチモン)などに用いられている。
ビスマス( Bi )
天然産のビスマス単体を自然蒼鉛という。ビスマスの鉱物には,自然蒼鉛(自然ビスマス: Bi ),輝蒼鉛鉱(輝ビスマス鉱: Bi2S3 ),蒼鉛土(ビスマイト: Bi2O3 )がある。工業的には,鉛,モリブデン,タングステンの精錬工程での副産物を利用している。
淡く赤みがかった柔らかく脆い金属である。大気中で表面に生成した薄い酸化物被膜(不動態)により安定に存在できるが,酸化物被膜の厚みの影響(光屈折)で多彩な色を示す。
ビスマス単体は,液体の密度(融点の液体 10.05×106 gm-3 )が固体の密度(室温付近 9.78×106 gm-3 )より大きくなる特性がある。この特性を示す元素単体は,ケイ素,ゲルマニウム,ガリウム,ビスマス,アンチモンに限られる。
用途例
合金成分として用いることで,相手金属の融点より低くできる。この性質を利用し,鉛フリーはんだの添加材,低融点合金( 融点 70 ℃のウッドメタル Bi 50% , Pb 26.7% , Sn 13.3% , Cd 10% )に使われる。また,大きな熱電効果を示すので,熱電交換素子(テルルとの合金)として実用化されている。
高温超伝導体の 1 成分としても用いられ,ビスマスを含む超伝導物質はビスマス系高温超伝導物質と呼ばれる。
他に,医薬品(整腸剤)の原料として用いられてもいる。
ページの先頭へ
14,15,16族:放射性元素について
フレロビウム( Fl )
14族のフレロビウムは,原子番号 114 ,原子量( 289 )で,ロシアのドゥブナ合同原子核研究所で初めて合成され,次いでアメリカのローレンス・リバモア国立研究所やドイツの重イオン研究所でも合成に成功した人工の放射性元素である。
元素名は,ドゥブナ合同原子核研究所の設立者ゲオルギー・フリョロフにちなんで命名された。
モスコビウム( Mc )
15族のモスコビウム(Moscovium;Mc)は,原子番号 115 ,原子量( 289 )で,ロシアのドゥブナ合同原子核研究所,アメリカのローレンス・リバモア国立研究所の共同研究チームが生成に成功した人工の放射性元素である。2015年12月に,国際純正・応用化学連合(IUPAC)と国際純粋・応用物理学連合(IUPAP)で新元素として認定され,暫定名称ウンウンペンチウム( Uup )から改称された。
ポロニウム( Po )
16族のポロニウムは,原子番号 84 ,原子量( 209 )で,安定同位体は存在しない元素である。ポロニウムは,ウラン系列の過程でラドン 222 の壊変でポロニウム 218 が生じ,これの壊変過程で複数の放
射性同位体が生成する。天然では,ポロニウム 210 の半減期が138.4日と一番長い,人工ではポロニウム 209 の半減期は102年である。
全ての同位体が強力な放射能を持ち,過去に暗殺の手段に用いられたことでも知られる。
リバモリウム( Lv )
16族のリバモリウムは,原子番号 116 ,原子量( 293 )で,ロシアのドゥブナ合同原子核研究所でキュリウムとカルシウムから合成した人工の放射性元素である。
元素名は,アメリカのローレンス・リバモア国立研究所の所在地(カルフォルニア州リバモア)にちなみ命名された。
ページの先頭へ