第一部:化学と物質構造・原子の構造
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,原子の構造について,【電子軌道】, 【陽子と電子の数】 に項目を分けて紹介する。
電子軌道
原子核周りの負の電荷を持つ電子の挙動は,正の電荷を持つ原子核による静電ポテンシャル( 3次元)の中でのシュレディンガー方程式(量子力学の波動関数)で説明される。これにより,原子のみならず分子中の電子の挙動を検討できる。
詳細は,量子化学の専門書を参照してもらうこことし,結論を言うと,電子は不連続のエネルギー順位で規定される電子軌道に分配される。
電子の取り得る軌道は,主量子数( main quantum number ) n ,方位量子数( azimuthal quantum number ) l (エル) ,磁気量子数( magnetic quantum number ) m で指定される。
主量子数 n
軌道の大きさとエネルギーを決定し,1, 2 , 3 , …の整数値をとる。これは,電子殻 K 殻( n=1 ), L 殻( n=2 ), M 殻( n=3 ), … に対応する。
方位量子数 l
軌道の形を決定し,0 , 1, 2 , … n-1の整数値をとる。これは,s 軌道( l=0 ),p 軌道( l=1 ),d 軌道( l=2 ),f 軌道( l=3 ),h 軌道( l=4 )に対応する。すなわち,K 殻 ( 主量子数 n=1 ) では l = 1 - 1 = 0となり,s 軌道しかとりえないが, M 殻 ( 主量子数 n=3 ) では l = 0,1,n-1=2 ,すなわち s 軌道( l=0 ),p 軌道( l=1 ),d 軌道( l=2 )をとることができる。
磁気量子数 m
各軌道を決定し,0 , ± 1, ± 2 , … ± l の整数値をとる。従って,s 軌道は, l = 0, m = 0 で 1 つの軌道を,p 軌道は l = 1 , m = -1 , 0 , 1 で 3 つの軌道を,d 軌道は l = 2 , m = -2 , -1 , 0 , 1 , 2 となり 5つの軌道を持つことができる。
一般に電子軌道は,1 s , 2 s , 2p , 3s , 3p , 3d, …のように,主量子数 n +軌道の形で表記される。
電子は,フェルミ粒子のため,パウリの排他原理により, 1 つの軌道には異なるスピン角運動量( spin wave function :上向きのスピン,下向きのスピン)の2つの電子しか入れない。
従って,s 軌道に 2 個,p 軌道で 6 個,d 軌道は 10 個,f 軌道には 14 個の電子しか収容できない。
電子殻に収容される最大の電子数は,2n2となるが,通常の状態では,電子はエネルギー順位の低い軌道から収容される。
軌道のエネルギー順位は,概ねで, 1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p ・・・・,である。(注目点 : d 軌道,f 軌道と s 軌道の順位)
【参考】
電子状態( electronic structure, electronic state, electronic property )
電子構造ともいい,原子,分子における電子の状態をいう。ある電子状態が別の状態に変わることを電子遷移( electronic transition )という。
フェルミ粒子( fermion )
スピン角運動量の大きさが半整数( 1/2 , 3/2 , 5/2 , … )倍の量子力学的粒子,その代表が電子。
パウリの排他原理( Pauli principle )
2つ以上のフェルミ粒子は,同一の量子状態を占めることはできない。
電子軌道( electron orbital )
当初の原子モデル(惑星モデル)では,電子の運動を“orbital”と考え,軌道と訳されているため,電車の軌道,衛星軌道などのように,一定の法則に従って運動するときの筋道と錯覚されるが,最新の原子モデルでは,electron(電子の)orbital(軌道のようなもの)は,電子の状態を波動関数(wave function)で表したもので,雲のように広がった連続的分布をしていると考えられている。この電子の分布は,電子雲(electron cloud)ともいわれる。
下図には,参考のため,第 4 周期で最外殻となりうる電子軌道の計算例を示す。この軌道の形(電子雲ともいう)が,化学結合の形式や結合角に大きく影響する。
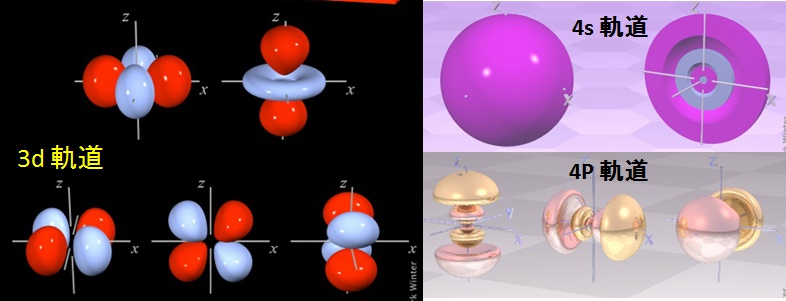
原子の電子配置
元図の出典:Sheffield大学(英国)Winter Group HP
ページのトップへ
陽子と電子の数
原子核に含まれる陽子の数は,元素の種類により一義的に決まる。さらに,電気的に中性な原子では,原子核の周りを陽子の数と同じ数の電子が取り巻く。
陽子の数はその元素の原子番号と同じになる。すなわち,元素の原子番号( atomic number )が分かれば,陽子の数が分かり,電気的に中性の場合の電子数が分かることになる。
原子番号 = 陽子の数 = 電気的中性な場合の電子の数
「元素と周期表」で解説したように,周期表は,単体や化合物の性質で元素を分類し,原子量の順番で整理したものである。その後の研究で,原子を取り巻く電子の構造が明らかになり,電子構造と周期表の相関が明白になった。
すなわち,原子の
主な元素(周期表の 4 周期まで)の電子配置( electron configuration )を下図に示す。
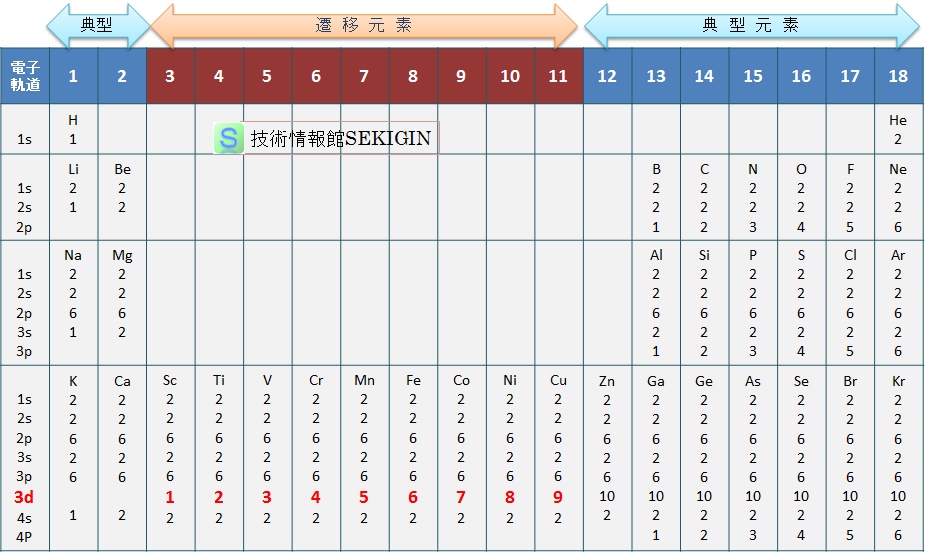
原子の電子配置
第 1 周期は,主量子数 1 ( K 殻)なので,電子軌道は 1 s 軌道のみで最大で 2個の電子しか収容できず,水素とヘリウムの 2元素のみとなる。
第 2 周期の元素は,主量子数 2 (L 殻)なので,電子軌道は 1 s 軌道,2 s 軌道,2 p 軌道をとる。従って,収容できる電子数は,最大で 10 個( 10 元素)となり,全て典型元素である。
第 3 周期までは, s 軌道,p 軌道の順に電子が収容される。
しかし,3 d 軌道より,4 s 軌道のエネルギー順位が低いため,先に 4 s 軌道に電子が収容される。このため,主量子数 3 の 3 d 軌道はまだ空の状態であるが,第4周期に分類される。典型元素と遷移元素にみられる特性の違いは,3 d 軌道の状態の違いによる。
まとめると,原子周りの電子は,エネルギー順位の低い軌道から収容され,その元素の化学的性質は,完全に電子で埋まっていない最も外側の軌道にある電子(最外殻電子: outermost electron )に依存する。実際に,周期表の族(縦の列)は,上図の「原子の電子配置」で示されるように,最外殻電子の配置が同じになっている。
なお,ヘリウム ( He ),ネオン ( Ne ),アルゴン ( Ar ),クリプトン ( Kr ) など 18 族(希ガス類という)は,最外殻の軌道が電子で満たされている。これが,原子の安定に寄与し,一般的な条件で単原子分子として存在できる理由である。
ページの先頭へ