第三部:化学反応 酸化・還元反応
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,酸化還元反応の理解に資するため, 【酸化還元とは】, 【酸化と酸化剤】, 【還元と還元剤】, 【酸化数】 に項目を分けて紹介する。
酸化還元とは
数多くある化学反応は,反応機構( reaction mechanism )でいくつかの型に分類される。その中で,酸化還元反応( oxidation-reduction reaction )や酸・塩基反応( acid-base reaction )は,基本的な化学反応の代表に挙げられる。
酸化還元反応( oxidation-reduction reaction )
反応物から生成物が生じる化学反応において,反応物と生成物の間で電子の授受のある反応をいう。
酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が,同時に進行する。
すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それぞれの反応を別個に扱うことはできない。
例えば,身近な現象として,加熱した鉄表面が空気中の酸素と反応して酸化鉄を生成する腐食は,複数種の化学反応の結果であるが,一般的には,単に “酸化反応” と称する例が多い。
2Fe + O2 → 2FeO
この反応は,イメージ図に示すように,鉄原子が 2 つの電子を失い,その電子が酸素分子に与えられる反応である。
この時,鉄( Fe )に注目すると,この反応は酸化反応といえるが,酸素( O2 )に注目するとこの反応は還元反応になる。
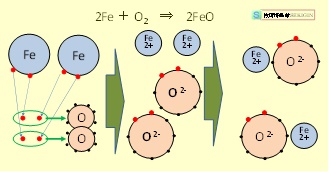
鉄と酸素の酸化還元【イメージ】
2Fe + O2 → 2FeO
このように,化学的には,酸化反応と還元反応が単独で存在することはなく,必ず同時に起きるため,単に“ 酸化反応”と称さず,“鉄の酸化反応” と対象物を明記した呼称が望ましい。
化学平衡において,注目する物質の右方向の反応が酸化過程であっても,左方向では還元過程の反応となり,その逆過程の物質が同時に存在する。
A + B ⇆ A* + B*
A → A* を酸化反応とすると,B → B*は還元反応である。
逆反応では,B* → B が酸化反応で,A* → A は還元反応となる。
このように,化学平衡では,注目する物質を A としたとき“ A の酸化・還元反応”と称することで誤解を避けられる。
ページの先頭へ
酸化と酸化剤
酸化( oxidation )
対象とする物質(原子)が電子を失うことである。
酸化反応には,酸素と化合する反応が多いため,一般的には,物質が酸素と化合して酸化物になる反応のみを酸化と誤解しているケースが少なくない。
実際には,物質から水素が奪われる反応,酸素や水素の関わらない反応も少なくない。
反応後に,化学反応に関わる元素の酸化数(後述)が増えた場合に,その物質は酸化されたという。
酸化をまとめると
・酸素と化合して酸素を含む化合物になる反応。
・水素を含む化合物が水素原子を失う反応。
・物質が電子を失う反応。
・酸化数が増加する反応。
酸化剤( oxidizing agent , oxidant など)
対象とする物質を酸化する為に使用する物質をいう。すなわち,注目した物質を酸化させることを目的とした場合に,意図的に選択した酸化還元反応において,酸化剤自体は電子を受け取り還元される物質(電子受容体)である。
次の酸化還元反応で,
A + B → A* + B*
A → A* を酸化反応とすると,A は酸化されたと受動態で表現する。このとき,B は A を酸化した物質,すなわち酸化剤となり,自身は還元されている。
ページの先頭へ
還元と還元剤
還元( reduction )
対象とする物質(原子)が電子を受け取ることでである。
金属酸化物から酸素を奪い金属単体を得る反応など,物質から酸素を奪う反応をいう場合が多い。実際には,水素と化合する反応や酸素や水素の関与しない反応も少なくない。
反応後に,化学反応に関わる元素の酸化数(後述)が減った場合に,その物質は還元されたという。
還元をまとめると
・酸素を含む化合物が酸素を失う反応。
・水素と化合して水素を含む化合物になる反応。
・物質が電子を受け取る反応。
・酸化数が減少する反応。
還元剤( reducing agent , reductant など)
対象とする物質を還元する為に使用する物質をいう。すなわち,注目した物質を還元させることを目的とした場合に,意図的に選択した酸化還元反応において,電子を放出し酸化される物質(電子供与体)である。
次の酸化還元反応で,
A + B → A* + B*
B → B* を還元反応とすると,B は還元されたと受動態で表現する。このとき,A は B を還元した物質,すなわち還元剤となり,自身は酸化されている。
ページの先頭へ
酸化数
【分子内結合】で紹介した内容を抜粋して紹介する。
酸化数( oxidation number )
単体や化合物に含まれる原子の酸化・還元状態の理解を助けるために導入された考え方である。
酸化では,物質が電子を失い,失った電子の数を正 ( + ) の酸化数とする。還元とは,逆に電子を受け取り,受け取った電子の数を負 ( - ) の酸化数とする。
化合物の名称においても,酸化鉄(Ⅱ)は FeO ,酸化鉄(Ⅲ)はFe2O3 のように,酸化数をつけることで化合物を構成する原子の酸化,還元程度から物質を明確に区別できる。
酸化数の表示
化合物の名称に酸化数を表示する場合に,文献や専門書では,ローマ数字(Ⅰ,Ⅱ,・・・),アラビア数字( 1 ,2 ,・・・)のいずれも使われている。特に,金属イオンの名称は,酸化鉄の例に示したようにローマ数字を用いるのが慣例になっている。
酸化数の決め方(基本)
① 単体の酸化数は 0 とする。
② 通常は,化合物中の酸素( O )の酸化数を -2 ,水素( H )の酸化数を +1 とする。
ただし,過酸化水素( H2O2 )の酸素 -1 ,NaHなどの水素化物の水素 -1 など例外もある。
③ 単原子イオンの酸化数は,例えば,Fe2+ は +2 (+Ⅱ) などそのイオンの価数に等しい。
④ 化合物を構成する原子の酸化数の総和は 0 になる。(電荷的中性を保持する)
⑤ 多原子イオンを構成する原子の酸化数の総和は価数に等しい。
共有結合の化合物では,共有電子対が電気陰性度の大きい原子にすべて移動したと仮定することで,イオンの場合と同様に酸化数を決められる。
多原子イオン,例えば SO42- において,硫黄 S の酸化数 +6 ,酸素 O の酸化数 -2 であるので,酸化数の総和は ( +6 )+( -2 )×4 = -2 となり,多原子イオンの価数 ( 2- ) に等しくなる。
ページの先頭へ