第五部:有機化学の基礎 アルコール・カルボン酸
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,アルコールの反応性に関連し, 【酸塩基反応,酸化反応】, 【脱水反応】, 【エステル生成反応,置換反応】 に項目を分けて紹介する。
酸塩基反応,酸化反応
アルコールの化学反応は,酸塩基反応,酸化反応など O–H 結合で起きる反応と脱水反応,エステル生成反応,置換反応のように C–O 結合で起きる反応に分けることができる。
酸塩基反応
基本的に中性であるが,水と同様に,弱い酸,弱い塩基として作用することを前節の【アルコールの特性】で紹介した。
酸としてのアルコールは,水酸化ナトリウム( NaOH )などの金属水酸化物と僅かしか反応できないほどの弱い酸である。
しかし,アルコールは,リチウム( Li )やナトリウム( Na )などのアルカリ金属,や水素化ナトリウム( NaH ),ナトリウムアミド( NaNH2 ),グリニヤール試薬などの強い塩基に対しては,R-OH が酸として働き,一般式 R-O- で表されるアルコキシドイオン( alkoxide ion )との塩( R–ONa ,R–OMgBr など)を生成する。
グリニヤール試薬( Grignard reagent )
一般式 R-MgX ( R :有機基,X :ハロゲン)で表される 有機マグネシウムハロゲン化物 で,有機合成には欠かせない有機金属試薬である。
酸化反応
一般的に,第一級アルコールを酸化剤と共に加熱すると,アルデヒド( -CH=O )を経由してカルボン酸( -COOH )まで酸化される。
第一級アルコール: RCH2OH → RCHO → RCOOH
第二級アルコールは酸化されてケトン( >C=O )になる。
第二級アルコール: R(R')CHOH → R(R')CO
第三級アルコールは,ヒドロキシ基の付く炭素に水素を持たないので,一般的な条件では酸化され難い。
酸化剤
一般的な過マンガン酸カリウム( KMnO4 ),酸化クロム(Ⅵ)( CrO3 :三酸化クロム,無水クロム酸),重クロム酸ナトリウム( Na2Cr2O7 )などを用いることができる。
しかし,第一級アルコールの酸化を中間段階のアルデヒドで止めようとする場合には,これらの酸化剤では強すぎるため,クロロクロム酸ピリジニウム( pyridinium chlorochromate : PCC )が用いられる。
PCC は,有機合成に用いられる代表的な酸化剤のひとつで,酸化クロム(VI)の濃塩酸溶液に等モル量のピリジン( C5H5N )を加えて得られる示性式 (C5H5NH)+ ClCrO3- で表されるものである。
C5H5N + HCl + CrO3 → (C5H5NH)+ ClCrO3-
ページの先頭へ
脱水反応
アルコールの化学反応は,酸塩基反応,酸化反応など O–H 結合で起きる反応と脱水反応,エステル生成反応,置換反応のように C–O 結合で起きる反応に分けることができる。
濃硫酸と加熱すると脱水反応( Dehydration reaction )が起きる。アルコールの脱水反応は,エーテル( R-O-R' )を生成する分子間脱水と,アルケン( R-C=C-R' )の生成する分子内脱水に分けられる。
分子間脱水: ROH + R'OH → ROR' + H2O
分子内脱水: RCH2 - CH(OH)–R' → RHC=CHR' + H2O
分子間脱水(エーテルの生成)
アルコールの分子間脱水では,一般的に対称エーテル( R=R' )が得られる。非対称エーテル( R≠R' )を合成する場合は,一般的にはウィリアムソンエーテル合成( Williamson ether synthesis )が用いられる。
これは,基質のアルコールに強塩基( NaH など)を反応させて得たナトリウムアルコキシド( R–O-Na+ )を用いて,ハロゲン化アルキル( R'–X )と反応させて非対称エーテル( R-O-R' )を得る方法である。
分子内脱水(アルケンの生成)
分子内脱水などの脱離反応( elimination reaction )では,結合している水素原子数の少ない方から水素原子が失われる。これをザイツェフ則( Saytzeff's rule )という。なお,上式の水素原子数は,RCH2<R’ の場合である。
分子内脱水によるアルケンの生成には,E2 脱離過程( 2分子脱離反応)の酸触媒( H3O+)として硫酸やリン酸と共に加熱する方法,ルイス酸であるアルミナ( Al2O3 )を加熱( 350 ~ 400 ℃)しアルコール蒸気を通す方法,E1 脱離過程( 1分子脱離反応)を利用した脱水試薬として塩化ホスホリル( POCl3 )と塩基性アミン溶媒のピリジン( C5H5N )を用いる方法などがある。
硫酸を酸触媒として用いた場合の反応例
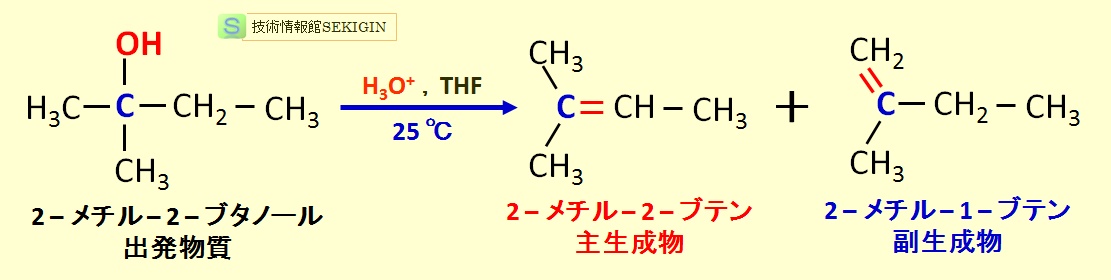
第三級アルコールの 2–メチル–2–ブタノールをテトロヒドロフラン( IUPAC 名 Oxolane ; THF )などの溶媒中で,硫酸( H2SO4 )水溶液を酸触媒( H3O+ )として分子内脱水が起き,図に示すように,ザイツェフ則に従う 2–メチル–2–ブテンが主要な生成物として得られる。
しかし,副生成物として,炭素数の多いメチル基の水素が失われ,2–メチル–1–ブテンも同時に生成する。
アルコールの分子内脱水反応例
エタノール(エチルアルコール:第一級アルコール,95% H2SO4 ,170℃)
C2H5OH → CH2 = CH2
1–ブタノール( n–ブチルアルコール:第一級アルコール,75% H2SO4 ,140℃)
C4H9OH → CH3CH = CHCH3 (主)+ C2H5CH = CH2 (副)
2–ブタノール( sec–ブチルアルコール:第二級アルコール,60% H2SO4 ,100℃)
C2H5CHOHCH3 → CH3CH = CHCH3 (主)+ C2H5CH = CH2 (副)
1–ブタノール,2–ブタノールとも 2–ブテンが主生成物となる点に留意が必要である。これは,E2 脱離過程で生成するカルボニウムイオンの転位の影響を受けたためで,1–ブテンを得たい場合は,カルボニウムイオンの転移が起きない方法の選択が必要である。
2–メチル–2–プロパノール( tert–ブチルアルコール:第三級アルコール,20% H2SO4 ,90℃)
(CH3)3COH → (CH3)2C = CH2
脱水反応の反応性は,反応に必要な硫酸濃度と加熱温度で比較すると,酸化反応とは異なり,第一級アルコール<第二級アルコール<第三級アルコールの順に高いと考えられる。
ページの先頭へ
エステル生成反応,置換反応
アルコールの化学反応は,酸塩基反応,酸化反応など O–H 結合で起きる反応と脱水反応,エステル生成反応,置換反応のように C–O 結合で起きる反応に分けることができる。
エステル生成反応
エステル( ester )は,カルボン酸誘導体の一つとして紹介しているが,自然界を構成する有機化合物の中で,最も広く分布している化合物である。
エステルは,有機酸や無機酸のオキソ酸と,アルコールやフェノールのようなヒドロキシ基を含む化合物との脱水縮合反応で得られる化合物である。
一般的には,カルボン酸とアルコールから成るカルボン酸エステル( carboxylate ester )を指すことが多い。
RCOOH + R'OH → RC(O)OR' + H2O
カルボン酸エステルの特性基( R–C(O)O−R' )をエステル結合( ester bond )と呼ぶ。プラスチック容器やロープ,繊維などに用いるポリエステル( polyester )は,エステル結合で重合された有機高分子材料を指す。
エステルには,一般的なカルボン酸エステルの他に,チオエステル(カルボン酸とチオール: R−C(=O)−SR' ),リン酸エステル(リン酸とアルコール: RO−P(=O)(–OR')–OR" ),硫酸エステル(硫酸とアルコール: RO−S(=O)2−OR ),硝酸エステル(硝酸とアルコール: RO–NO2 ),炭酸エステル(炭酸とアルコール: RO–C(=O)–OR' )などがある。
置換反応
ヒドロキシ基が他の基に置換される反応を求核置換反応( nucleophilic substitution reaction )という。
アルコールを濃塩酸などの濃厚なハロゲン化水素酸(ふっ化水素を除く),ハロゲン化リンやハロゲン化チオニルと強い条件で反応させると,ハロゲン化アルキルに変わる。この反応の反応性は,第一級アルコール<第二級アルコール<第三級アルコールの順に高い。
ROH + HX → RX + H2O X:Cl ,Br ,I
しかし,反応条件を変える(例えばアルカリ性条件)とハロゲン化アルカンからアルコールのほうへ平衡が戻る。(ハロゲン化アルカンからアルコールの製造に利用)
ROH + HX ← RX + H2O X:Cl ,Br ,I
上記の例はアルコールの特性を紹介するための物で,工業的にハロゲン化アルキルを得るためには,ハロゲン種別に適した試薬を用いる場合,アルケンを出発物質とする場合など種々の方法がある。
ページの先頭へ