第五部:有機化学の基礎 脂肪族炭化水素の基礎
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学工業で活用される鎖式不飽和炭化水素に関連し, 【アルケンとは】, 【アルケンの製造】, 【アルケンの付加反応】, 【開裂反応・アリル置換反応】 に項目を分けて紹介する。
アルケンとは
アルケン( alkene )
炭素と水素で構成される炭素原子間の二重結合を 1個持つ鎖式不飽和炭化水素をいい,一般式 CnH2n ( n ≧ 2 )で表される。
結合エネルギー
アルケンの二重結合は,σ結合 1つとπ結合 1つから成り立つ。
単結合,二重結合や三重結合の 炭素・炭素間の結合エネルギーを比較すると,σ結合 1つの単結合( C–C:C2H6 )の結合エネルギーが 366.4 kJ /molである。
これに対し,σ結合 1つ,π結合 1つで成り立つ二重結合( C=C:C2H4 )の結合エネルギーは,714 kJ/molである。
また,σ結合 1つ,π結合 2つで成り立つ三重結合( C≡C:C2H2 )の結合エネルギーは,956.6 kJ/molである。
単結合より二重結合,三重結合の結合エネルギー(総和)は大きいが,結合の数で割った値で比較すると,二重結合は単結合の二倍に満たず,三重結合は単結合の三倍に満たない。また,三重結合は二重結合の 3/2倍に満たない。
このことは,何れの場合のσ結合のエネルギーが等しいと仮定すると,σ結合とπ結合の結合エネルギーは,σ結合 > 二重結合のπ結合 > 三重結合のπ結合の関係にあることを示唆する。
一方で,炭素・水素間( H-C–:C2H6 )の結合エネルギーが 414 kJ/molと,炭素・炭素間のσ結合エネルギーより大きい。
以上より,アルケンなどの多重結合を持つ化合物では,結合エネルギーの低いπ結合の開裂による付加反応(他の分子と反応し,単結合を持つ飽和化合物になる反応)が起こりやすいことが分かる。
立体構造
多重結合周りの構造例を下図に示す。図から分かるように,多重結合の炭素-炭素結合距離は,結合エネルギー(総和)が大きくなるほど短く,炭化都合>二重結合>三重結合の順である。
また,多重結合は結合まわで回転できないため,二重結合は平面,三重結合は直線の構造が維持される。
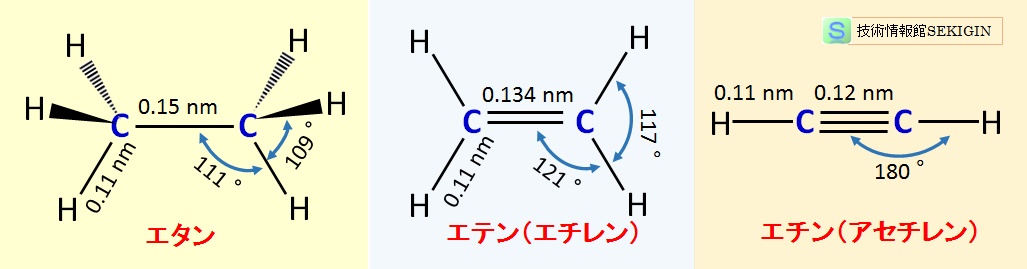
エタン,エチレン,アセチレンの立体構造
アルケンの物理的性質は,本質的にはアルカンと同様であり,水に不溶で非極性溶媒によく溶け,密度は水より小さく,沸点は炭素数の増加に伴い上昇するが,分岐があると沸点が下がる。
アルカンと異なる点は,二重結合のπ電子の影響で,アルカンより双極子モーメントが多少高くなる。
また,二重結合周りの回転ができないため,ハロゲンなどの極性基を持つシス (Z) ‐トランス (E) 異性体間では,トランス異性体に比較しシス異性体の極性が高く,シス異性体の沸点がトランス異性体より高くなるなどの極性の影響が出る。
アルケンの分子構造と安定性
アルケンの分子構造が分子のエネルギー状態に与える影響についてみてみる。
構造の影響は,同じ分子式で,構造の異なるアルケンを用いて,後述の水素添加反応における反応熱(水素化熱)で比較できる。
同じ分子式( C4H6 )の構造異性体の水素化熱は,一置換基の 1–ブテン( CH3CH2–CH=CH2 )で -126 kJ /mol ( -30.1 kcal /mol ) ,二置換基の 2–メチル–1–プロペン( (CH3)2C=CH2 )では -119 kJ /mol ( -28.4 kcal /mol ) である。
立体異性体の水素化熱は,二置換基の 2–ブテン( CH3CH=CHCH3 )のシス体で -120 kJ /mol ( -28.6 kcal /mol ) ,トランス体では -116 kJ /mol ( -27.6 kcal /mol ) である。
これらより,二置換基の化合物の水素化エネルギーは,一置換基の化合物より約 6~10kJ/mol 低いことが分かる。また,二置換基の化合物の立体異性体であるトランス体はシス体より約 4kJ/mol 低いことが分かる。
まとめると,アルケンの分子は,二重結合炭素の置換基の多い方が安定(超共役という)で,シス体より立体ひずみ(立体障害)の小さいトランス体が安定であるといえる。
ページの先頭へ
アルケンの製造
工業的製法
石油の精製で得られる軽質ナフサ(沸点範囲 35 ~ 80 ℃程度)などを水蒸気と混合し,800 ~ 900 ℃程度の高温で熱分解することで,水素,メタン,エチレン,エタン,プロピレン,ブタン,ブテンなどの混合物が得られる。アルカンの熱分解はクラッキング( cracking )といわれる。
この熱分解物を蒸留分離することで必要な成分が得られる。原料としてのエチレンを生産する設備は,エチレンプラントと呼ばれる。
クラッキングでは,次の反応例に示すように,アルカンの C–C ,C–H 結合が切断し生成したラジカル( R・ )によりアルケンを含め種々の化合物を生成する。
C2H6 → 2CH3・
CH3・ + C2H6 → CH4 + C2H5・
C2H5・ → CH2=CH2 + H・
CH3・ + C2H5・ → C3H8
C2H5・ + C2H5・ → CH2=CH2 + C2H6
実験室的製法
アルケンの一般的な実験室的製法には,二分子脱離反応( E2 )のアルコールの脱水,ハロゲン化アルキルの脱ハロゲン化水素やアルキンの還元などがある。なお,二重結合の位置の保護を目的に用いられる隣接二ハロゲン化物の脱ハロゲン化についても紹介する。
アルコールの脱水による製造
アルコールの脱水によるアルキンの製法は,アルコールの反応で紹介するように,硫酸やアルミナ( Al2O,sub>3 :ルイス酸)などの酸触媒や塩化ホスホリル( POCl3 )を用いる方法がある。
ハロゲン化アルキルの脱ハロゲン化水素による製造
ハロゲン化アルキルは,脱ハロゲン化水素( dehydrohalogenation )により容易にアルケンになる。
脱ハロゲン化水素反応とは,ハロゲンの結合する炭素に隣接した炭素上の水素原子がハロゲン原子と同時に除去される反応である。
この反応では,強塩基の水酸化アルカリ( KOH )のアルコール溶液などが試薬として用いられる。
この反応の特徴が理解できる反応例を次に示す。
CH3CH2CH2Cl + KOH → CH3CH=CH2 + KCl + H2O
CH3CH(Cl)CH3 + KOH → CH3CH=CH2 + KCl + H2O
CH3CH2CH2CH2Cl + KOH → CH3CH2CH=CH2 + KCl + H2O
CH3CH2CH(Cl)CH3 + KOH → CH3CH=CHCH3(80%),CH3CH2CH=CH2(20%)+ KCl + H2O
最後の例に示すように,脱ハロゲンで 2 種のアルケンの生成が可能な場合は,アルコールの脱水と同様に,アルキル基の数の多い方のアルケン,すなわちより安定なアルケンが容易に生成し,これが主生成物となる。
この反応の反応性は,第一級( R–X )<第二級( R–CH(X)–R' )<第三級( R–CR'(X)–R" )の順に高い。
アルキンの還元による製造
アルキン( R–C≡C–R' )は,三重結合が炭素鎖の末端にない限り,シス (Z) ‐トランス (E) 異性体のどちらかが主生成物となる。シス異性体の生成とトランス異性体の生成は,用いる還元試薬により決まる。
例えば,アルキンを液体アンモニア中のナトリウム(又はリチウム)で還元すると主生成物としてトランス‐アルケンが得られる。
Lindlar 触媒(パラジウム触媒)や P–2 触媒(硼化ニッケル)で水素添加するとシス‐アルケンが得られる。
触媒を用いることで,触媒表面にアルキンが吸着し,アルキン分子の同じ側に水素が着くために,ほぼ完全にシス‐アルケンが得られると考えられている。
なお,三重結合が末端にある場合( R–C≡CH )は,当然のことながら異性体を生成しない。
隣接二ハロゲン化物の脱ハロゲン化
隣接二ハロゲン化物の脱ハロゲン化では,例えば,R–C(R')X–C(R")X–R'" の二ハロゲン化物を亜鉛処理することでアルケン R–C(R')=C(R")–R'" が得られる。これは,アルケンの製造に用いるより,二重結合の位置の保護(アルケンの再生)を目的に用いられる。
すなわち,あるアルケン( R–C(R')=C(R')–R )は不活性な四塩化炭素溶液中でハロゲン( X2 )と容易に反応し二ハロゲン化物( R–C(R')X–C(R')X–R )になる。次いで,分子の他の部分に適当な処理( R–C(R')X–C(R")X–R'" )をした後,脱ハロゲン化で元の位置に二重結合を再生( R–C(R')=C(R")–R'" )することができる。
ページの先頭へ
アルケンの付加反応
アルケンの二重結合は,σ結合と結合エネルギーの弱いπ結合で構成されている。このため,π結合が開裂し,新たにσ結合を生成する反応(付加反応)が多重結合を持つアルケンやアルキンに特徴的な反応となる。
付加反応( addition reaction )
付加反応は,アルケンと求電子剤との求電子付加反応( electrophilic addition ),カルボニルと求核剤(グリニャール試薬など)との求核付加反応( nucleophilic addition ),非極性付加反応のラジカル付加( free - radical addition )に分けられる。
求電子付加反応とは
求電子付加反応とは,求電子剤( electrophile )の作用でπ結合が解裂し,新たに 2 つのσ結合を生成する反応である。
求電子剤とは,求電子試薬,求電子種などとも呼ばれ,電子の授受をともない化学結合する反応で,電子を受け取る(奪う)側の化学種をいい,陽イオン( H+ ,NO2+ など),中性のルイス酸など分極で陽性の部位を持つ中性分子( HCl ,ハロゲン化アルキル,カルボン酸ハロゲン化物,カルボニル化合物など),求核剤( nucleophile )の接近で分極される分子( Cl2,Br2 など),酸化剤,カルベン(オクテット則を満たさない二配位の炭素),ラジカルなどである。
求電子付加反応では,下図に示すように,求電子剤が –C=C– のπ電子を奪い,カルボカチオン中間体( –CY–C+– )を経由し,–CY–CZ– を形成する。Y≠Z の場合に,Y が結合する炭素の位置に対し選択性が生まれる。炭素の選択性は,マルコフニコフ則(経験則)に従う場合が多い。
一般的には,C–Y ,C–Z結合のエネルギーが,π結合,Y-Z結合エネルギーより小さい場合が多いので,ほとんどの求電子付加反応は発熱反応となる。
なお,カルボカチオン( carbocation )とは,炭素原子上に正電荷を持つカチオン(陽イオン)をいう。
マルコフニコフ則( Markovnikov’s rule )
二重結合を持つ炭化水素の求電子付加反応に関する経験則である。非対称形の反応剤が非対称形のアルケンに付加するとき,二重結合の二個の炭素のうち水素原子数の多いほうの炭素に,電気的に陽性な原子団(水素など)が結合する。
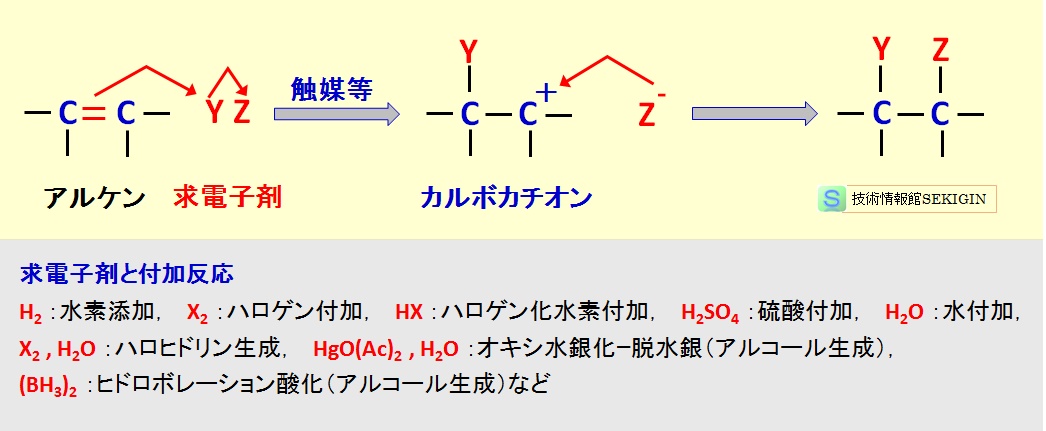
アルケンの求電子付加反応
求電子付加反応の例
次には,求電子付加反応の例として,水素付加, ハロゲン付加, ハロヒドリン生成, ハロゲン化水素付加, 硫酸付加, 水付加, オキシ水銀化‐脱水銀, ビドロボレーション‐酸化 を紹介する。
水素添加
水素添加( hydrogenation )は,水素ガスを用い,アルケンに水素原子を付加する還元反応で,水素化( hydrogenation )とも呼ばれる。
水素化は,発熱反応であるが,水素分子と直接反応することはなく,触媒が必要である。このため,接触水素化( catalytic hydrogenation )や接触還元( catalytic reduction )とも呼ばれる。
水素添加には,触媒としてニッケル( Ni ),ルテニウム( Ru ),パラジウム( Pd ),白金( Pt )が良く用いられる。これらの触媒表面に吸着した水素分子が水素原子に解離され,これとアルケンとが反応する。このため,アルケンの官能基に応じて適切な触媒が選択される。
CH3CH = CH2 + H2 ( Ni ) → CH3CH2CH3
戻る
ハロゲン付加
アルケン( R–C(R')=C(R")–R'" )は,四塩化炭素( CCl4 )など不活性な溶媒中で塩素( Cl2 ),臭素( Br2 )と容易に反応し隣接二ハロゲン化物( R–C(R')X–C(R")X–R'" )になる。
CH3CH = CH2 + Cl2 → CH3CH(Cl)CH2Cl
過熱や紫外線照射すると,副反応として置換反応が起きるので,この反応は室温付近以下の温度で実施される。なお,一般的な条件では,よう素( I2 )とは反応しない。
戻る
ハロヒドリン生成
アルケンに水の存在下で塩素( Cl2 )や臭素( Br2 )を添加させると,隣接炭素原子にハロゲン( X )と水酸基( OH )が着いたハロヒドリン( halohydrin )が生成する。
ハロゲンと水酸基の位置は,最初にハロゲンが安定な二級陽イオンを生成するように付加し,その後水酸基が付加する。
CH3CH = CH2 + Cl2 + H2O → [ CH3C+HCH2Cl + HCl + OH- ] → CH3CH(OH)CH2Cl + HCl
戻る
ハロゲン化水素付加
アルケン( R–C(R')=C(R")–R'" )は,ハロゲン化水素とアルケンが溶解可能な比較的極性のある溶媒(例えば酢酸)中で塩化水素( HCl ),臭化水素( HBr ),よう化水素( HI )と反応し,相当するハロゲン化アルキル( R–C(R')X–C(R")H–R'" )を生成する。
ハロゲンの結合する炭素は,マルコニコフ則(水素の多い炭素に水素)に従う。
CH3CH = CH2 + HCl → CH3CH(Cl)CH3
(CH3)2C = CHCH3 + HCl → (CH3)2C(Cl)CH2CH3
臭化水素については,塩化水素,よう化水素と異なり,過酸化物の有無で結合する位置が変化する。過酸化物がない場合は,マルコニコフ則に従うが,過酸化物があると水素の多い炭素に臭素が結合(逆マルコニコフ則)する。これは,不純物程度の過酸化物でも影響される。
戻る
硫酸付加
アルケンと冷濃硫酸との接触で容易に反応し,一般式 ROSO3H の硫酸水素アルキルが生成される。例えば,室温の濃硫酸(濃度はアルケンの種類による)にアルケンの気体を吹き込むだけで,潮解性のある固体として硫酸水素アルキルが得られる。
硫酸濃度は,第一級のエチレンで 98 %,第二級のプロペン(プロピレン)で 80 %,第三級のイソブチレン( 2 – メチル プロペン,iso –ブテン)で 63 %と反応性の高いアルケンほど低い濃度で良い。
付加反応は,マルコニコフ則に従う。
CH3CH = CH2 + H2SO4 (80%) → CH3CH(OSO3H)CH3
得られた硫酸水素アルキルは,固体のため容易に単離できる。
また,硫酸水素アルキルを含む硫酸溶液を加熱することで,硫酸水素アルキルと同一のアルキル基を持つアルコールが得られるので,アルコールの合成に用いられる。
CH3CH(OSO3H)CH3 + H2O → CH3CH(OH)CH3 + H2SO4
戻る
水付加
いわゆる水和反応( hydration reaction )であり,比較的反応性に富むアルケンを酸の存在下で処理することで,生成物としてアルコールが得られる。
この付加反応は,マルコニコフ則に従う。
(CH3)2C = CH2 + H2O → (CH3)2C(OH)CH3
戻る
オキシ水銀化‐脱水銀
アルコールの合成に用いられる。この反応は,マルコニコフ則に従う。
水の存在下で,酢酸水銀(Ⅱ)( Hg(OAc)2 )と反応して,ヒドロキシ水銀化合物を生成する。
>C = C< + H2O + Hg(OAc)2 → >C(OH) – C(HgOAc)<
この,C=C 二重結合に –OH と –HgOAc の付加をオキシ水銀化という。
次の段階で,水素化ホウ素ナトリウム( NaBH4 )を用いて還元することで,–HgOAc が –H に置換(脱水銀)され,アルコールが生成する。
>C(OH) – C(HgOAc)< →(NaBH4)→ >C(OH) – CH<
戻る
ビドロボレーション‐酸化
アルコールの合成に用いられる。この反応は,逆マルコニコフ則に従う。
溶媒としてテトラヒドロフラン( THF:C4H8O ,オキソランともいわれる)を用い,ジボラン( (BH3)2 )をアルケンに作用させることで,ヒドロボレーションが起こり,アルキルボラン( R3B )が生成する。溶媒中では,ジボランはボラン‐テトラヒドロフラン錯体を形成し,ボラン単体であるかのような反応性を示す。
プロペンの場合を模式的に示すと次のように,トリプロピルボランが生成する。
6CH3CH = CH2 + (BH3)2 → 2CH3CH2CH2BH2 + 4CH3CH = CH2 → 2(CH3CH2CH2)2BH + 2CH3CH = CH2 → 2(CH3CH2CH2)3B
次いで,過酸化水素を用いて酸化すると,ホウ素が –OH で置換され,1–プロパノールが得られる。
CH3CH2CH2BH2 ,(CH3CH2CH2)2BH ,(CH3CH2CH2)3B →(H2O2 , OH-)→ CH3CH2CH2OH
前述の水付加では,2–プロパノールが生成し,1–プロパノールを得ることができない。
ページの先頭へ
開裂反応・アリル置換反応
開裂反応
アルケンの開裂反応( cleavage )とは,二重結合が完全に切断されて,アルケン分子が分子量の小さい 2つの分子になることである。
この反応の代表的なものとして,オゾン分解( ozonolysis )が知られている。オゾン分解では,第一段階で二重結合にオゾンの付加が起こり,オゾニド( ozonide )が生成し,次の段階でオゾニドの加水分解(亜鉛触媒など)で開裂生成物(アルデヒドやケトン)が得られる。
過マンガン酸カリウムなどの強力な酸化剤を用いると,アルデヒドの代わりにカルボン酸や二酸化炭素が得られる。
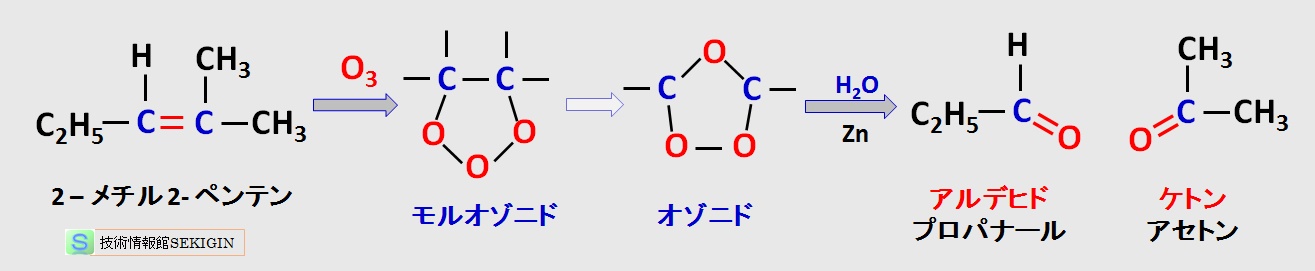
オゾン分解例
付加反応では,二重結合の位置に水酸基やハロゲンなどの官能基が付加する反応であった。
アリル置換は,アルケンの二重結合を保持したまま,二重結合に隣接する炭素(アリル位)の水素が選択的にハロゲンに置換される求核置換反応の一種である。
次には,同じ出発物質での求電子付加反応とアリル置換反応の違いを紹介する。
CH3CH = CH2 + Cl2 → CH3CH(Cl)CH2Cl 求電子付加反応(四塩化炭素中,低温)
CH3CH = CH2 + Cl2 → ClCH2CH = CH2 + HCl アリル置換反応(気相,500~600 ℃)
ページの先頭へ