第五部:有機化学の基礎 芳香族炭化水素
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,芳香族炭化水素の基本となるベンゼンに関連し, 【ベンゼンの製法】, 【ベンゼンの特徴】, 【芳香族求電子置換反応とは】, 【ハロゲン化,ニトロ化,スルホン化】, 【フリーデル・クラフツ反応】 に項目を分けて紹介する。
ベンゼンの製法
ベンゼンの工業的製造法には,ナフサの接触改質,水蒸気クラッキングの副産物,トルエンの脱アルキル化,トルエンの不均化などがある。
ナフサの接触改質( catalytic reforming )
沸点 80~200 ℃の石油精製品(重質ナフサ)と水素ガスとの混合物を 500~525 ℃( 8~50 気圧)で触媒(塩化白金; PtCl2 や塩化ロジウム; RhCl3 )と接触させることで,脂肪族炭化水素が環を形成し,水素を失って芳香族炭化水素の混合物が得られる。
ナフサの水蒸気クラッキング( steam cracking )の副産物
ナフサなどの高分子量の飽和炭化水素をエチレンやプロピレンなどの低分子量の不飽和炭化水素生成する工業過程で,副産物として得られる芳香族化合物を分離精製して得る。
トルエンの水素脱アルキル化( toluene hydrodealkylation )
トルエン( C6H5CH3 )と水素の混合物を 500~600 ℃,40~60気圧で触媒( Cr ,Mo ,酸化白金など)と接触することで,
C6H5CH3 + H2 → C6H6 + CH4
の反応(収率 95 %)でベンゼンが得られる。
トルエンの不均化( disproportionation )
同一種の分子 2 個以上が反応して異なる種類の生成物を与える化学反応を不均化という。
トルエンを加熱することで, 2 分子の反応
C6H5CH3 → C6H6 + C6H5(CH3)2
によってベンゼンとキシレンを生成する。
同様に,アセチレン( C2H2 )を赤熱した鉄触媒と接触させることで,3 分子の反応
3CH≡CH → C6H6
でベンゼンが得られる(ヘキストワッカー法)。
ページの先頭へ
ベンゼンの特徴
ベンゼンの安定性
ベンゼン( C6H6 )の分子軌道形成は,共役ジエンの安定性で紹介した原理と同様に,6 つの炭素の p 原子軌道から,環状の構造に関連して分子軌道(ヒュッケル法)を求めると,下図に示すように,3 つの結合性軌道(Ψ1 ,Ψ2 ,Ψ3 )と3 つの反結合性軌道(Ψ4* ,Ψ5* ,Ψ6* )に分かれる。
分裂した分子軌道のエネルギー順位は,Ψ1 <Ψ2 =Ψ3 <Ψ4* =Ψ5* <Ψ6* となる。
Ψ2 とΨ3 及びΨ4* とΨ5* のように,同じエネルギーを持つ軌道は,縮退( degeneracy )しているという。なお,図に示すように,Ψ3 とΨ4* は,炭素上にπ電子密度の無い節ができている。
このように,ベンゼン環では,p 電子が環(共役系)全体に非局在化するすることで安定化する。ベンゼンの安定化エネルギー 150 kJ /mol は,共役ジエンの約 27 kJ /mol に比較しても著しく大きい。
【参考】
ヒュッケル法( Hückel method )とは,ドイツのヒュッケルが提案した量子化学的手法を用いた分子軌道の計算法で,エチレン,1,3–ブタジエン,ベンゼン等のπ電子共役分子の分子軌道計算の入門用として広く用いられる。
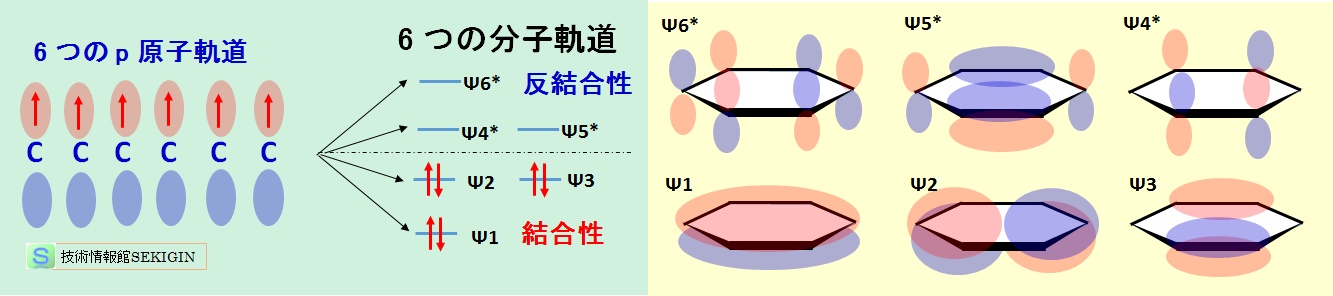
ベンゼンの分子軌道
芳香族炭化水素は,ベンゼン環の安定性が高いため,脂肪族炭化水素で紹介した求核置換反応より求電子置換反応を受けやすい。
芳香族炭化水素の求電子置換反応は,別途に芳香族求電子置換( electrophilic aromatic substitution )と呼ばれる。芳香族炭化水素の中で,電子求引性置換基を持つハロゲン化アリールは,求核剤の攻撃を受けて置き換えられる反応の芳香族求核置換( nucleophilic aromatic substitution )を行うこともできる。
ここでは,芳香族求電子置換反応(親電子置換反応ともいう)を紹介し,その他の芳香族特有の求核置換反応やニトロ基の還元反応,芳香族スルホン酸のアルカリ融解反応,アルキルベンゼン側鎖の酸化反応,アルキルベンゼンのベンジル位臭素化,芳香環の接触水素化などについては専門書に譲り,ここでは割愛する。
ページの先頭へ
芳香族求電子置換反応とは
ベンゼン環の 6 個のπ電子は,環平面の上下に位置している。すなわち,ベンゼン環は電子密集のうえに立体的にも攻撃試薬が近づきやすい。
このため,通常は求核剤(ルイス塩基,電子供与体)として作用し,その反応のほとんどは求電子剤(ルイス酸,電子受容体)との間で起きる。
具体的には,ベンゼンなどの芳香環に求電子剤( E+ )が攻撃し,主に水素と置き換わる形式で化学反応が進む。
主な芳香族求電子置換反応には,ハロゲン化反応( –F ,–Cl ,–Br ,–I ),ニトロ化反応( –NO2 ),スルホン化反応( –SO3H ),フリーデル・クラフツ( Friedel – Crafts ),アルキル化反応( –R ),フリーデル・クラフツアシル化反応( –COR )などがある。
反応機構
ハロゲン化反応の臭素( Br2 )による芳香族求電子置換反応を例に,共役する二重結合に求電子剤が攻撃するアルケンの求電子付加反応と対比しながら反応機構を紹介する。
不活性溶媒であるジクロロメタン( CH2Cl2 )中の臭素は,求核剤のアルケンから攻撃を受け分極( Brδ- Brδ+ )することで求電子剤として直ちに反応できる。
しかし,ベンゼンなどの芳香環のπ電子は,アルケンに比較し求電子剤との反応性が乏しい(活性化エネルギーが大きい)ため,反応するためには触媒( FeBr3 など)が必要となる。触媒は,臭素を分極( Br3Feδ-…Br Brδ+ )し,求電子剤としての攻撃性を高める作用がある。
アルケンの求電子付加反応,芳香族求電子置換反応とも,はじめに求電子剤がπ電子を奪い,臭素が付加したカルボカチオン( carbocation )中間体を形成する。なお,カルボカチオンとは,炭素原子上に正電荷を持つカチオン(陽イオン)をいう。
図に示すように,ベンゼン環のカルボカチオンは,共役ジエンで紹介したアリル型カルボカチオン 3 つの共鳴形と考えられている。
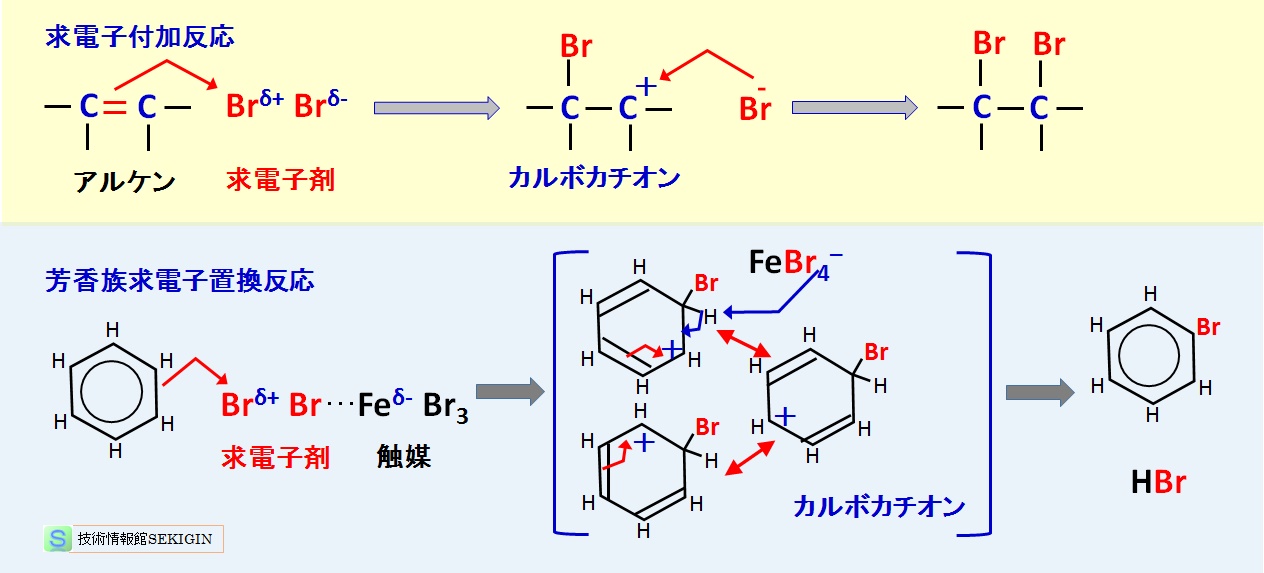
求電子付加反応と芳香族求電子置換反応の比較
アルケンに比較し安定なベンゼン環は,活性化エネルギーが高く,ベンゼン環が中間体のカルボカチオンに変化する反応は吸エルゴン反応であり触媒を必要とし,中間体から生成物になる反応は発エルゴン反応である。
【参考】
ギブズエネルギー変化が負で自発的に起きる反応を発エルゴン反応( exergonic reaction )といい,ギブズエネルギー変化が正で自発的に起きない反応は吸エルゴン反応( endergonic reaction )という。
吸エルゴン反応は,加熱,電気分解,他の発エルゴン反応との組み合わせなど,外部から仕事を与えなければ進行しない反応である。他の発エルゴン反応と組み合わせることを共役という。
ページの先頭へ
ハロゲン化,ニトロ化,スルホン化
ハロゲン化反応( –X )
ふっ素( F2 )
反応性が激しく,直接のフルオロ化反応ではモノフルオロ芳香族生成物( C6H5F )の収率が悪い。
塩素( Cl2 )
触媒( FeCl2 )存在下で反応しクロロベンゼン( C6H5Cl)を与える。
臭素
反応機構の解説で既に紹介した。
よう素( I2 )
芳香環に対して不活性なため,過酸化水素のような酸化剤や塩化銅( CuCl2 )のような加えることでよう素がよう素イオン( I2 +2Cu2+ → 2I+ + 2Cu+ )に酸化され,強力な求電子剤となりヨウドベンゼン( C6H5I)が得られる。
ニトロ化反応( –NO2 )
濃硫酸( H2SO4 ),濃硝酸( HNO3 )の混合物と芳香環との反応でニトロ化( C6H5NO2 )できる。この反応では,酸混合物で生じるニトロイルイオン(ニトロニウムイオンNO2+ : O=N+=O )が求電子剤となる。
スルホン化反応( –SO3H )
発煙硫酸( H2SO4 + SO3 )と芳香環との反応でスルホン化され,ベンゼンスルホン酸( C6H5SO3H )が得られる。この場合に求電子剤となるのは,HSO3+ 又は SO3 である。
スルホン化は,可逆反応であり,加熱した希酸水溶液中では脱スルホン化される。
ページの先頭へ
フリーデル・クラフツ反応
フリーデル・クラフツ アルキル化( Friedel-Crafts alkylation reaction )
芳香族化合物のアルキル化,アシル化に無機ハロゲン化合物が触媒として作用することを発見( 1877 年)したシャルルフリーデル( Charles Friedel )とジェームスクラフト( James Mason Crafts )に因んで,フリーデル・クラフツ反応( Friedel-Crafts reaction )と命名された。
フリーデル・クラフツ アルキル化は,芳香族求電子置換反応の中で最も有用な反応の一つといわれ,無機ハロゲン化物を触媒として用い,ハロゲン化アルキルと触媒から生成するカルボカチオンを求電子剤として,ベンゼン環にアルキル基を導入する反応である。
例えば,塩化アルミニウム( AlCl3 )触媒の存在下で 2 –クロロプロパン( CH3CH(Cl)CH3 )を用いて,ベンゼンからクメン(イソプロピルベンゼン: C6H5CH(CH3)2 )が得られる。
この反応は,有機合成化学で重要であるが,次に示す特徴(欠点)を有する。
第一にハロゲン化アルキルのみに適用でき,ハロゲン化アリール(芳香環上の水素をハロゲンに置換したもの: Ar–X )やハロゲン化ビニル( CH2=CHX )とは反応しないこと,第二に強い電子求引基(アミノ基など)で置換された芳香環では適切なアルキル化が困難なこと,第三に反応の第一段階で反応を止め難く,ポリアルキル化が起きやすいこと,第四に第一級ハロゲン化アルキル( R–X )を用いた場合にアルキル基の骨格転移が起きることがあるなどである。
フリーデル・クラフツ アシル化( Friedel-Crafts acylation reaction )
塩化アルミニウムを触媒として用い,芳香族化合物をカルボン酸塩化物やRCOCl と反応させると,アシル基( –C(O)R )を導入できる。
アシル化は,アルキル化より反応性が劣るため,アルキル化で紹介した特徴(欠点)が起き難い。
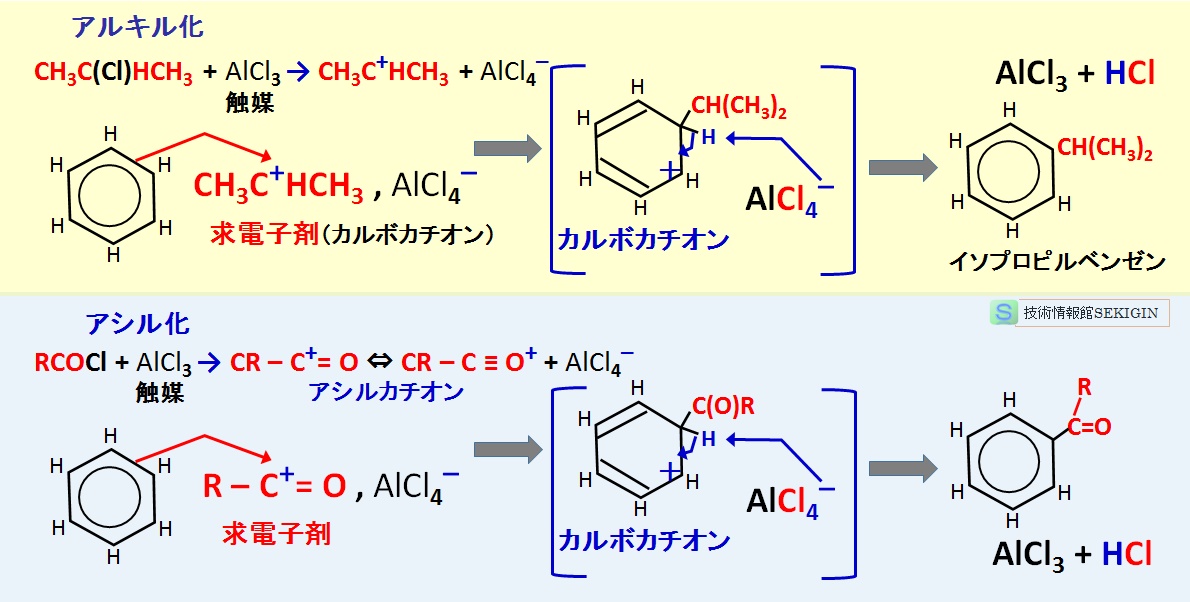
フリーデル・クラフツ反応例
ページの先頭へ