第五部:有機化学の基礎 脂肪族炭化水素の基礎
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,有機化合物のエナンチオマー(鏡像関係)以外の立体異性体を意味する 【ジアステレオマー】に関連し, 【配座異性体(回転異性体)】, 【シス‐トランス異性体(幾何異性体)】, 【シス―トランス異性体の表示法】 に項目を分けて紹介する。
ジアステレオマーとは
ジアステレオマー( diastereomer )
複数の不斉炭素を持つ化合物のうち,互いに鏡像ではない異性体,すなわちエナンチオマー以外の異性体である。
エナンチオマーは光学特性以外の物理的性質は等しい,しかし,ジアステレオマーは沸点・溶解度・極性などの物理的特性が異なる化合物である。
2つの不斉炭素を持つ化合物(異性体 4 )のジアステレオマーとエナンチオマーは,絶対立体配置の R/S表示法で示すと,RR体と SS体がエナンチオマーの関係に,RS体と SR体はキラリティが無く重なり合うメソ体の関係になる。これ以外の RR体と RS体などがジアステレオマーの関係になる。
シス‐トランス異性体とは
ジアステレオマーは,分子の結合軸周りでの回転の可否により次の 2種に分類できる。
配座異性体(回転異性体ともいわれる)
単結合についての回転や孤立電子対を持つ原子についての立体反転によって相互に変換可能な空間的な原子の配置である立体配座によるジアステレオマー.
シス‐トランス異性体(幾何異性体ともいわれる)
通常の条件で結合回りの回転が不可能な二重結合や環状構造おいて,一方の炭素に結合した置換基 Xと他方の炭素に結合した置換基 Yが同じ側にあるか,異なる側にあるかによるジアステレオマー。
【参考】
R/S表示法
不斉炭素に結合する 4個の置換基の優先順位( CIP 順位則)により Sまたは Rを用いる絶対的な立体配置の表示法である。この表示法は,IUPAC 命名法に基づいて絶対立体配置を示す際に広く用いられている。
不斉炭素が n個ある場合,その化合物の異性体は 2n個存在できる。この中から 2つ選択したときに,エナンチオマー,ジアステレオマー,あるいはメソ体の関係のものが得られる。
なお,メソ体とは,分子内にキラル中心を持つが,同時に対称面も持つためにキラリティを示さない化合物をいう。
ジアステレオマーのシス‐トランス異性体の表記には,同じ手順を用いる E /Z 表示法が用いられる。
E /Z 表示法
R/S表示法の CIP 順位則を適用し,4置換基(原子)に優先順位を付ける。
順位の高い置換基が同じ側にある場合を Z体( zusammen ドイツ語の同じ),反対側にある場合を E体( entgegen ドイツ語の逆)とする。
ページの先頭へ
配座異性体(回転異性体)
立体配座( conformation )
原子団の相対的な配置は,単結合周りで回転し自由に変化できる。室温で容易に変換できる空間配置をいう。
なお,似た日本語の用語立体配置( configuration )は三次元的な配置を示し,意味合いが全く異なるので誤用には注意する。
室温など通常の条件では,単結合周りの回転に関する立体配座の障害エネルギーは比較的小さく,分子はほぼ自由にその障壁を乗り越えることができる。このため,通常の条件では,配座の違いの区別や分離が困難である。
しかし,例えば,低温時の高分子化合物,立体障害となりうる大きな置換基の導入など,分子構造や環境条件によっては,回転の障害エネルギーが大きくなり,立体配座の違いを区別することができる場合がある。
これを配座異性体( conformer )や回転異性体( rotamer )と呼ぶ。
配座異性体( conformer )
立体配座は,下図に示すように,注目する単結合( A – B )と両端の置換基( X , Y )の位置関係(二面角)で区分される。二面角の関係は,分子構造の投影式としてニューマン投影式を用いると理解し易い。
二面角が 0度,120度の場合を重なり形配座やエクリプス配座といい,60度,180度の場合をねじれ形配座やスタッガード配座という。
また,二面角 0度のものをシス配座( cis )やシン配座( syn ),60度のものをゴーシュ配座( gauche ),180度のものをトランス配座( trans )やアンチ配座( anti )ともいう。
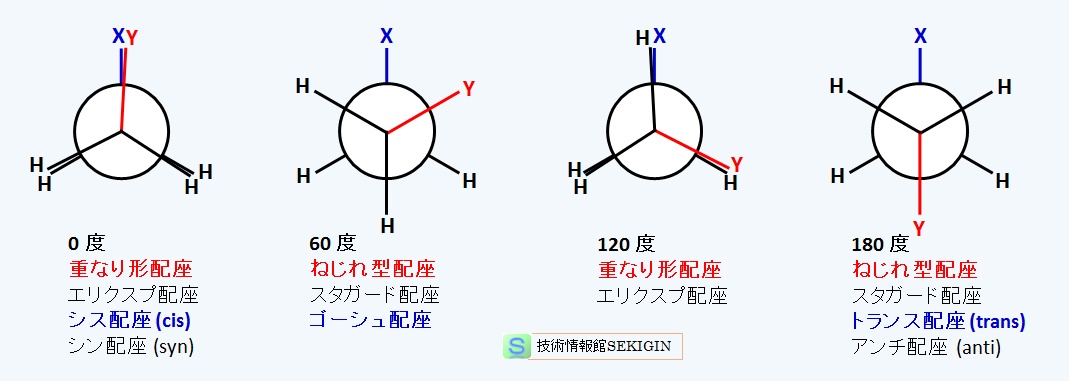
立体配座の二面角による分類例
いす型配座では全ての C–C 結合がねじれ型配座を持つが,ふね型配座では 2 本の C–C 結合が重なり配座を持つため,いす型配座の方が安定になる。
タンパク質,核酸,脂質,糖などの生体高分子の特徴も立体配座の影響を強く受けている。
ページの先頭へ
シス‐トランス異性体(幾何異性体)
通常の条件で単結合は自由に回転できるが,多重結合や環状化合物などは自由な回転が許容されない構造となる。
このような場合に,置換基の結合位置により,互いに重なり合わない立体配置を取ることで,分子が安定する。
例えば,結合角約 120 度の二重結合の炭素に異なる2つの置換基( R , R’ )を持つ場合には,置換基が同じ側に結合した化合物と異なる側に結合した化合物は,異なる化合物として認識される。これをシス‐トランス異性体( cis-trans isomer )という。
なお,シス‐トランス異性体は,IUPAC の推奨する呼称であるが,高等学校の化学教育など一般的には,IUPAC では推奨していないが,幾何異性体( geometrical isomer )の呼称がなじみ深い。
下図に示すように,二重結合や環状化合物など回転できない構造で,置換基が同じ側に並んでいる立体配置をシス( cis ),置換基が違う側に位置している立体配置をトランス( trans )と呼ぶのが一般的である。
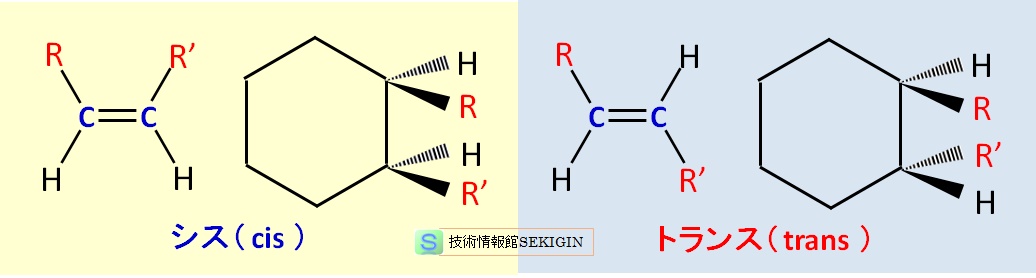
シス‐トランス異性体
ページの先頭へ
シス―トランス異性体の表示法
シス‐トランス異性体を表示する場合は,IUPAC では E /Z 表示を推奨しているが,高等学校の化学教育など一般的には,2 つの置換基を持つ簡単な化合物を用いた説明に cis /trans 表示を用いた解説が広く用いられている。
cis /trans 表示法
二重結合や環構造を持つ化合物において,上図に例示するように,2 つの置換基が同じ側にあればシス体( cis 体),反対側にあればトランス体( trans 体)とする。
二重結合につく置換基が 2 つの場合に用いても混乱しないが,3 つ以上の置換基を持つ場合には,混乱を避けるため,cis /trans 表示より E /Z 表示を用いることが推奨される。
環状化合物や飽和縮合環化合物の場合は,E /Z 表示を用いず,環の平面に対する位置関係から cis – trans 表示を用いる。
環構造が複雑な場合は,絶対配置を示す R /S 表示法を用いる。
E/Z表示法
二重結合を持つ化合物に対し,絶対配置を示すR /S 表示法で紹介した CIP 順位則を適用し,4 置換基(原子)に優先順位を付ける。
順位の高い置換基が同じ側にある場合を Z 体( zusammen ドイツ語の同じ),反対側にある場合を E 体( entgegen ドイツ語の逆)とする。
CIP 順位則
CIP 順位則には,分子の大きさ(原子数),鎖式と環式で複数の手順がある。ここでは,基本となる原子数が多くない鎖式脂肪族化合物の例を紹介する。
① 置換基の不斉炭素に直接連結している原子の原子番号の順。
例えば,置換基が水素( H ),メチル基( −CH3 ),アミノ基( −NH2 ),ヒドロキシ基( −OH )の場合は,直接結合の原子( H ,C ,N ,O )の原子番号順に,1 ヒドロキシ基,2 アミノ基,3 メチル基,4 水素の順になる。
② 直接結合する元素が同じ場合は,それに続いて結合する原子の原子番号を比較する。
③ 同様にして,結合する原子を比較し,違いが現れたとき,最も不斉炭素に近い相違点で順位を決定する。相違点から先にどんな原子が結合しても,相違点の原子でのみ比較し,次に続く他の原子は順位に影響しない。
例えば,ヒドロキシメチル基( –CH2–OH )とトリクロロエチル基( –CH2–CCl3 )の比較では,最初の相違が 2 番目の酸素と炭素で,3 番目の水素と塩素は無関係となり,ヒドロキシメチルの準位がトリクロロエチルより優先される。
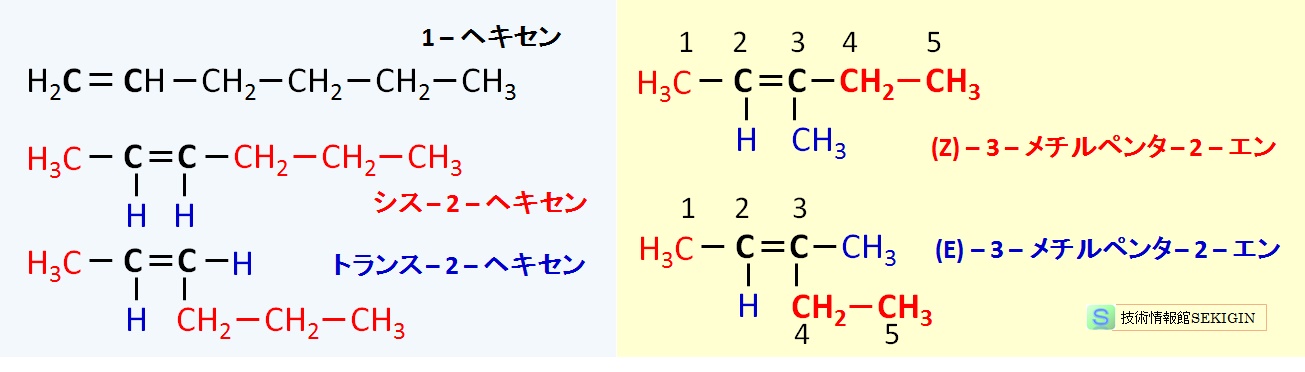
cis /trans 表示と E /Z 表示
炭素二重結合以外に,アゾ化合物( R–N=N–R' )や金属錯体(金属と非金属の原子が結合した構造を持つ化合物)などの無機化合物にもシス‐トランス異性体がある。
金属錯体の中で,MX2Y2 構造(例えば PtCl2(NH3)2 )や MX4Y2 構造( 例えば [ CoCl2(NH3)4 ]+ )の金属錯体は,Y 配位子(例では Cl )が背中合わせの方向に配位していればトランス体,隣り合って配位していればシス体となる。
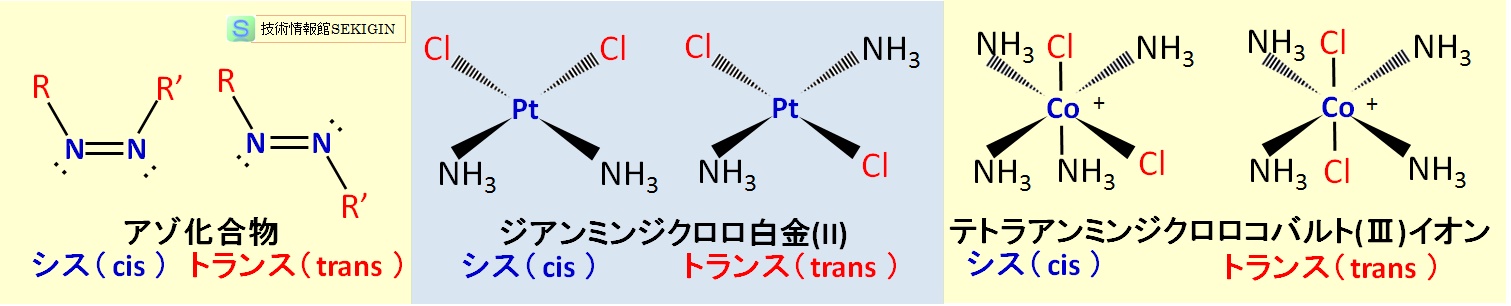
C = C 二重結合以外のシス-トランス異性体の例
ページの先頭へ