第五部:有機化学の基礎 芳香族炭化水素
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,フェノールの多様な反応性に関連し, 【フェノールの反応】, 【エーテルの合成】, 【求電子置換反応】, 【酸化反応】, 【呈色反応】, 【酸無水物との反応】 に項目を分けて紹介する。
フェノールの反応
工業用原料として用いられる フェノール類は,多様な反応を示す。ここでは,代表的な反応として,エーテルの合成,フェノール類の求電子置換反応,フェノール類の酸化反応,定性分析に用いる呈色反応,酸無水物との反応などを紹介する。
【参考】
フェノール類とは
炭化水素の水素原子をヒドロキシ基( -OH :水酸基やヒドロキシル基ともいう)で置き換えた化合物について,芳香環( aromatic ring :ベンゼン環やナフタレン環など)の水素原子を置換したもの,すなわちは芳香環にヒドロキシ基を持つ芳香族炭化水素をフェノール類( phenols )と呼ばれ,一般式 Ar–OH で表される。
脂肪族炭化水素の水素をヒドロキシ基で置き換えた場合はアルコール( alcohol )といい,一般式 R–OH で表され,フェノール類とは区別されている。
なお,芳香環以外の炭素にヒドロキシ基を持つ芳香族炭化水素は,芳香族アルコールという。
フェノール類の用途は広く,化学合成の原料以外に,消毒剤(フェノールなど),殺菌剤(チモールなど),抗酸化剤(ジブチルヒドロキシトルエン: BHT )として食品添加物,爆発物(ピクリン酸),酸塩基指示薬(フェノールフタレイン),パーキンソン病の治療薬(L-ドーパ),消炎剤や鎮痛剤などの医薬品(サリチル酸類)に用いられる。
ページの先頭へ
エーテルの合成
アルコールの反応で紹介したウィリアムソンエーテル合成( Williamson ether synthesis )と同様の機構でフェノール類からエーテルが合成できる。
まず,フェノール類の塩基によるプロトン( H+ )の引き抜きで,フェノキシドイオン( phenoxide ion )Ar–O- が生じる。
次いで,ハロゲン化アルキル( R–X )の求核置換反応( SN2 反応)で,エーテル( Ar–O–R )を生成できる。
Ar–OH + (K2CO3) → Ar–O- + H+
Ar–O- + R–X → Ar–O–R + X-
【参考】
エーテル結合( ether bond )
一般式 R−O−R' で表される化合物(エーテル)に含まれる −O− の部分をエーテル結合という。
アルコールの分子間脱水(エーテルの生成)
アルコールの分子間脱水では,一般的に対称エーテル( R=R' )が得られる。非対称エーテル( R≠R' )を合成する場合は,一般的にはウィリアムソンエーテル合成( Williamson ether synthesis )が用いられる。
これは,基質のアルコールに強塩基( NaH など)を反応させて得たナトリウムアルコキシド( R–O-Na+ )を用いて,ハロゲン化アルキル( R'–X )と反応させて非対称エーテル( R-O-R' )を得る方法である。
ページの先頭へ
求電子置換反応
フェノール類は,芳香族求電子置換反応( electrophilic aromatic substitution )で紹介したハロゲン化反応( –F ,–Cl ,–Br ,–I ),ニトロ化反応( –NO2 ),スルホン化反応( –SO3H ),フリーデル・クラフツアルキル化反応( –R ),フリーデル・クラフツアシル化反応( –COR )などを受ける。
フェノール類は,ヒドロキシ基の置換基効果(オルト-パラ配向性>活性化基) により,オルト位とパラ位の複数の箇所に置換できる。
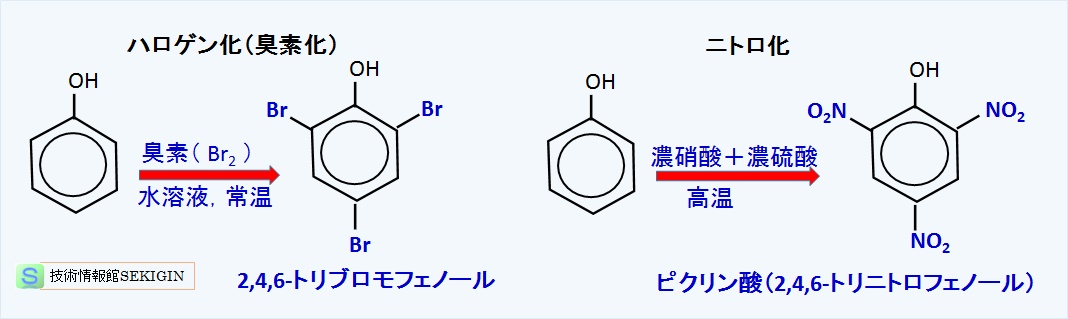
ハロゲン化反応
下図の左の例に示すように,フェノール水溶液と臭素( Br2 )水溶液を混合すると,常温でハロゲン化が進み,2 か所のオルト位とパラ位に三置換した2,4,6–トリブロモフェノールが得られる。
ニトロ化反応
フェノール水溶液に希硝酸( HNO3 )を低温で反応させると,ニトロ化反応により,オルト位,又はパラ位の何れか一箇所の水素原子が置換された 2–ニトロフェノール,又は 4–ニトロフェノールの一置換体が生成する。
下図の右の例では,濃硝酸と濃硫酸( H2SO4 )の混酸を高温で反応させることで,2つのオルト位とパラ位に三置換した 2,4,6–トリニトロフェノール(ピクリン酸)が得られる。
濃硫酸との混酸にすることで,濃硫酸によるスルホン化で濃硝酸による酸化を防止しつつニトロ化でき,三置換体が得られる。
フェノールの求電子置換例
ページの先頭へ
酸化反応
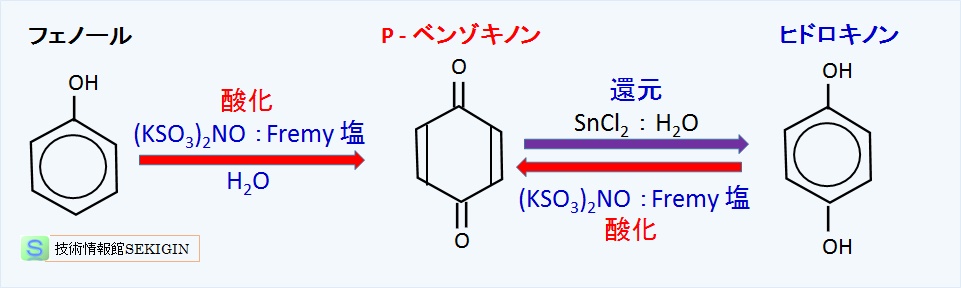
フェノール類は,第三級アルコールと同様に,ヒドロキル基の結合する炭素に水素を持たないので,酸化にはニトロソスルホン酸カリウム( (KSO3)2NO :Fremy 塩)などの強い酸化剤を用いて,ラジカル機構での酸化処理が採られる。
この方法では,下図に示すように,フェノールがシクロヘキサ-2,5-ジエン-1,4-ジオン( C6H4O2 : p-ベンゾキノンともいう)に酸化される。p-ベンゾキノンは,ホウ酸ナトリウム( NaBH4 )や塩化スズ( SnCl )で容易に還元され 1,4-ベンゼンジオール( C6H4(OH)2 :ヒドロキノン,p - ジヒドロベンゼンなどともいう)になる。
フェノールの酸化・還元
ページの先頭へ
呈色反応
フェノール類に,塩化鉄(Ⅲ)( FeCl3 )を反応させると,鉄イオン( Fe3+ )にフェノキシドイオン( phenoxide ion )Ar–O- が配位( 6 配位)した錯体を形成して紫系に呈色する。
6Ar–OH + FeCl3 → 3H+ + [Fe(O–Ar)6]3- + 3HCl
フェノール類の構造で色が異なり,フェノール,1 – ナフトールが紫,クレゾールで青,2 – ナフトールは緑,サリチル酸で赤紫色に呈色する。
塩化鉄(Ⅲ)との反応は,フェノール類以外では呈色しないため,フェノール性ヒドロキシ基を持つ化合物の簡易的な定性分析法として用いられている。
ページの先頭へ