第三部:化学反応 化学反応の分類
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
化学反応の分類には,立場の違いを反映した様々な分類がある。中には発見者にちなんで命名された反応,試薬名を冠した反応などの分類もある。
ここでは,化学反応機構に注目した分類の 【置換反応】, 【付加反応】, 【脱離状反応】, 【転移反応】 に項目を分けて紹介する。
置換反応
反応機構による化学反応の分類の一つである置換反応( displacement reaction )は,官能基が化合物の同一原子上で置き換わる化学反応である。
置換反応は,求核置換反応( nucleophilic substitution reaction )と求電子置換反応(親電子置換反応ともいう: electrophilic substitution reaction )に分けられる。
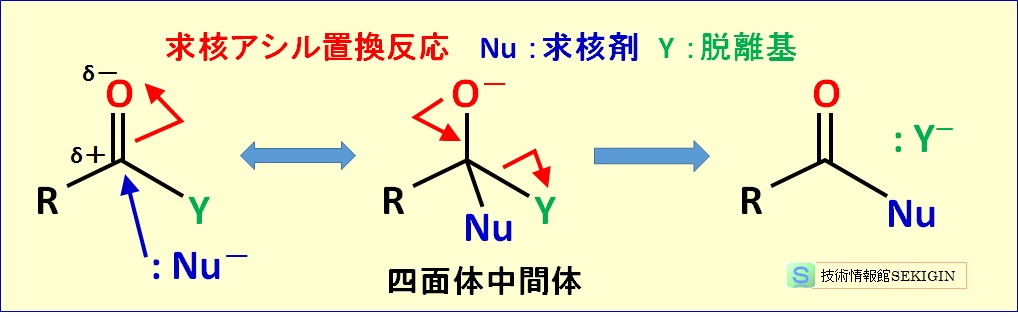
求核置換反応( nucleophilic substitution reaction )
対象とする化合物の反応中心の求電子剤に求核剤が攻撃・置換し,脱離基の脱離反応が起きる。従って,反応生成物は,求電子剤に求核剤が結合した化合物と脱離基となる。
カルボン酸誘導体の求核置換反応は求核アシル置換反応ともいう。
脂肪族炭素の求核置換反応には,反応の形態によって SN1 反応, SN2 反応に分けられる。
SN1 反応( Nuclephilic Substitution of Unimoleculer )
「一分子的求核置換反応」ともいい,先に化合物(求電子剤)の離脱基が完全に外れた後に,求核剤が攻撃し反応する。このため,生成物は, SN2 反応に見られる立体的な構造の制約が小さく,多くの場合は 2種の構造を採り得る。
反応速度は,脱離基が外れる段階が律速(反応速度を決定づける)となるため,求電子剤の濃度に依存する。
SN2 反応( Nuclephilic Substitution of Bimoleculer )
「二分子求核置換反応」ともいい,化合物(求電子剤)に試薬(求核剤)が,脱離基の背面から攻撃することで,脱離起と求核剤の置換が起きる。
反応は,離脱基の背面からの攻撃によるため,生成物の立体的な構造が制約され,一般的には反転(ワルデン反転)する。反応速度は,求核剤の結合と脱離基の離脱が協奏的に起きるので,求電子剤と求核剤それぞれの濃度に依存する。
求電子剤( electrophile )
求電子剤(きゅうでんしざい)は,主に有機化学で用いられる用語で,求電子試薬,求電子種,親電子剤ともいわれる。
電子の授受により化学結合を形成する化学反応において,電子を受け取る(奪う,共有する)側の化学種を指す。求電子剤は,反応する相手の電子密度の高い部分を攻撃する。
求核剤( nucleophile )
求核剤(きゅうかくざい)は,主に有機化学で用いられる用語で,求核試薬,求核種,親核剤ともいわれる。
電子の授受により化学結合を形成する化学反応において,電子を与える(共有させる)側の化学種を指す。求核剤は,反応する相手の電子密度の低い部分を攻撃する。
ワルデン反転( Walden inversion )
ロシアの化学者ワルデン( Paul Walden )が,1893年に,リンゴ酸の置換反応において,光学活性体の立体配置が反転(旋光性の反転)する現象を発見した。
求核置換反応において絶対立体配置の反転が起こる現象を発見者の名にちなんでワルデン反転と命名された。
この現象は,SN2 反応において通常観測されるが,特殊な場合を除き SN1 反応では観察されない。
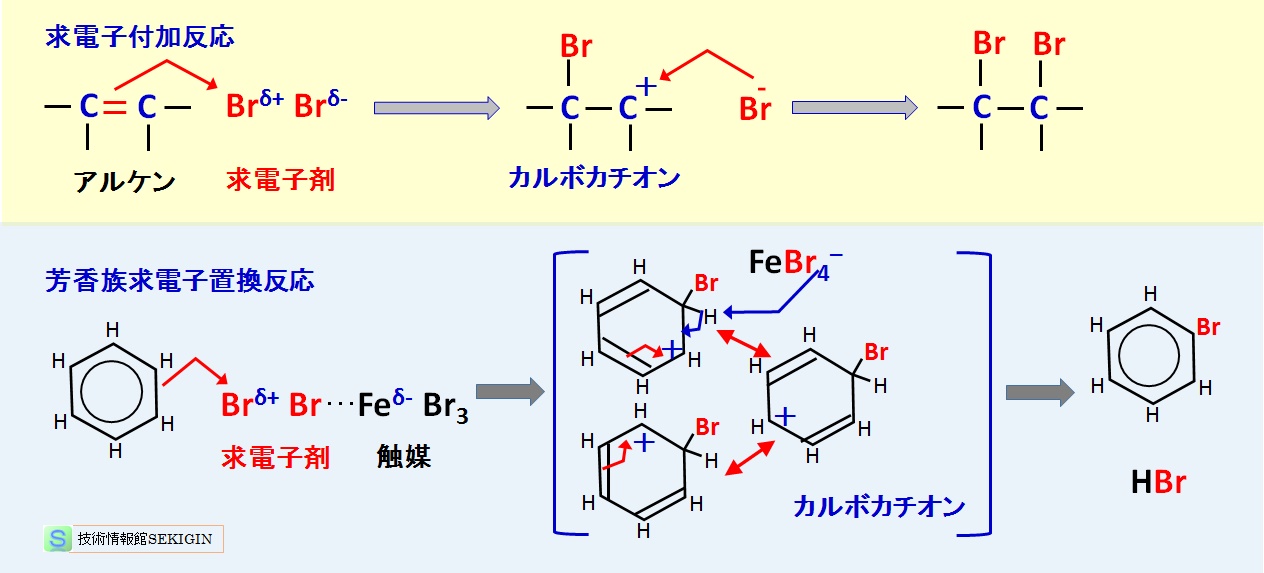
求電子置換反応
芳香環(ベンゼン環)によく見られる反応で,芳香族求電子置換反応と呼ばれる。ベンゼン核のπ電子に対して陽イオンが置換する。
例えば,ニトロ化反応では,硝酸( HNO3 )と硫酸( H2SO4 )の混酸中で生成するニトロニウムイオン( NO2+ )がベンゼン環の水素と置換しニトロ化する。
ページの先頭へ
付加反応
付加反応( addition reaction )は,多重結合が解裂し,別の分子などの原子団と新たな単結合を生成する反応で,反応生成物は,付加体と呼ばれる。
炭素化合物では,三重結合の結合エンタルピーが二重結合より小さいため,三重結合で最も起こりやすい。
付加反応は,加えた試薬の最初に攻撃する基の特性により,アルケンなどと求電子剤との求電子付加反応,カルボニルなどと求核剤との求核付加反応,非極性付加反応のラジカル付加( free - radical addition )に分けられる。
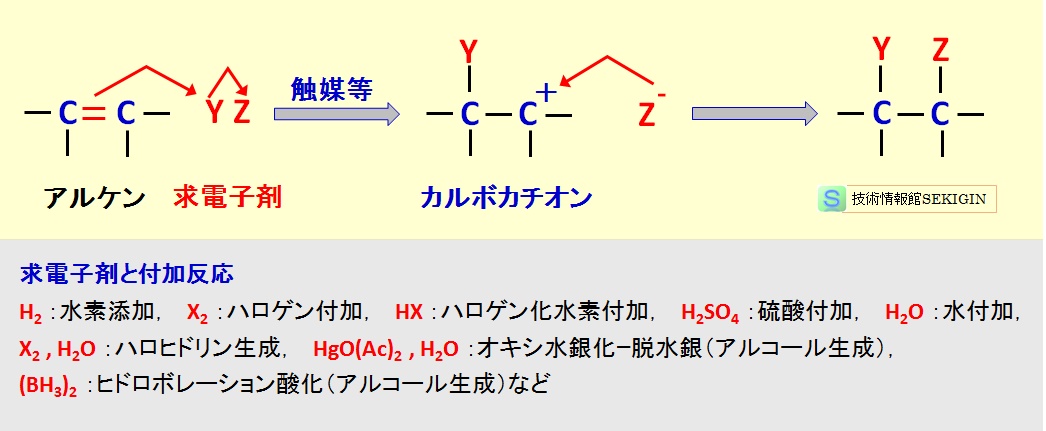
求電子付加反応( electrophilic addition )
求電子剤の作用で,アルケンやジエンのπ結合が解裂し,新たに 2 つのσ結合を生成する反応である。なお,ほとんどの求電子付加反応は発熱反応である。
一般化して説明すると,二重結合(又は三重結合)のπ電子に陽イオン種( X+ )の付加で生成したカルボカチオン( -C+ )を陰イオン種( Y- )が攻撃して付加反応が終結する。
X+ Y- + ( R’ – C = C – R )
⇒ ( R’ – X C – C+ – R ) + Y-
⇒ R’ – X C – CY – R
この時,X+ を求電子剤という。
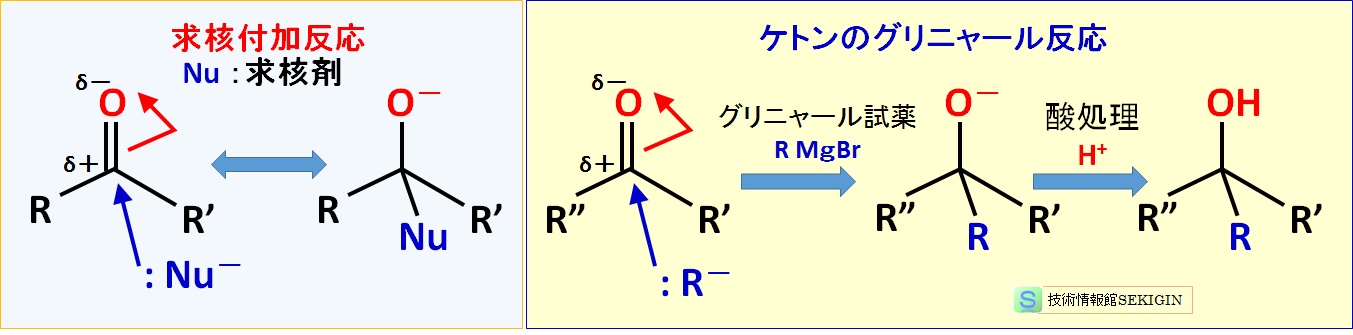
求核付加反応( nucleophilic addition )
多重結合を持つ化合物に求核剤が付加し,π結合の解裂で新たに2つの共有結合(σ結合)が生成する反応をいう。
求核付加反応は,炭素・炭素間に多重結合を持つアルケン( –C=C– ),アルキン( –C≡C– ),炭素とヘテロ原子間に多重結合を持つカルボニル基( >C=O ),イミン( R–C(=NR')R" ),ニトリル( R–C≡N )などで起きる。
一般化して説明すると,陰イオン種である求核剤( Y- )が付加することによってπ結合が解裂し,新たな共有結合を生成する付加反応である。求電子付加反応と異なり,負電荷は他の炭素-炭素結合に移動して陽イオン種( X+ )が付加する。
X+ Y- + ( R’ – C = C – R )
⇒ X+ + ( R’ – Y C – C – R- )
⇒ R’ – Y C – C – R X
ページの先頭へ
脱離反応
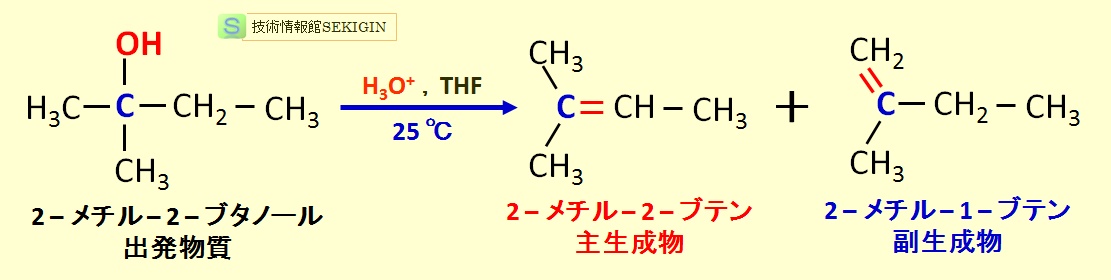
反応機構による化学反応の分類の一つである離脱反応( elimination reaction )は,原子団を放出して,小さい分子になる反応をいう。例えば,アルコール(エタノール)に濃硫酸を加えて加熱した時,分子内の脱水でアルケン(エチレン)が生成する分子内脱水反応は脱離反応である。放出された原子団は脱離基と呼ばれる。
反応機構には,1 つの分子から原子の脱離で生成したイオンから,さらに他のイオンが脱離し異なる化合物ができる 1 分子脱離反応と,2 つの分子が反応し,一方の分子で付加,又は置換反応が,他方の分子で脱離反応が同時(協奏的)に起きる 2 分子脱離反応(付加脱離反応)がある。
ページの先頭へ
転位反応
反応機構による化学反応の分類の一つである転位反応( rearrangement reaction )は,原子や原子団の結合位置を変えて,分子の骨格構造が変化する反応が転位反応である。
分子の骨格構造に変化を与えずに結合位置を変える場合は,日本語の読みは同じであるが,転移反応( transfer reaction )とよぶ。
転位反応には,分子骨格内で基が移動する分子内転位,一度遊離して他の分子に移動する分子間転位に分けられる。さらに,機構別に,求核転位,求電子転位,,シグマトロピー転位,ラジカル転位に分けられる。
ページの先頭へ