第五部:有機化学の基礎 芳香族炭化水素
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,工業用途の多いフェノールに関連し, 【フェノール類とは】, 【フェノール類の呼称】, 【主なフェノール類】, 【フェノールの製法】, 【フェノールの物性】, 【置換基効果】 に項目を分けて紹介する。
フェノール類とは
フェノール類( phenols )
炭化水素の水素原子をヒドロキシ基( -OH :水酸基やヒドロキシル基ともいう)で置き換えた化合物について,芳香環( aromatic ring :ベンゼン環やナフタレン環など)の水素原子を置換したもの,すなわちは芳香環にヒドロキシ基を持つ芳香族炭化水素をフェノール類と呼び,一般式 Ar–OH で表される。
脂肪族炭化水素の水素をヒドロキシ基で置き換えた場合はアルコール( alcohol )といい,一般式 R–OH で表され,フェノール類とは区別されている。
なお,芳香環以外の炭素にヒドロキシ基を持つ芳香族炭化水素は,芳香族アルコールという。
フェノール類の用途は広く,化学合成の原料以外に,消毒剤(フェノールなど),殺菌剤(チモールなど),抗酸化剤(ジブチルヒドロキシトルエン: BHT )として食品添加物,爆発物(ピクリン酸),酸塩基指示薬(フェノールフタレイン),パーキンソン病の治療薬(L-ドーパ),消炎剤や鎮痛剤などの医薬品(サリチル酸類)に用いられる。
ページの先頭へ
フェノール類の呼称
フェノール類は,脂肪族炭化水素のアルコールとは特性が大きく異なり,明確にアルコールと区別され,その構造的特徴により次のように称されている。
フェノール類の中で,最も単純な化合物は,ベンゼンの水素をヒドロキシ基で置き換えたフェノール( C6H5OH )である。
複数のヒドロキシ基を有するものはポリフェノール( polyphenol )と呼ばれる。
ベンゼン環に 2 つの置換基が着く場合に,3 種の構造異性体ができる。1 位と 2 位につく場合をオルト( ortho- , o- ),1 位と 3 位につく場合をメタ( meta- , m- ),1 位と 4 位につく場合をパラ( para- , p- )とする。
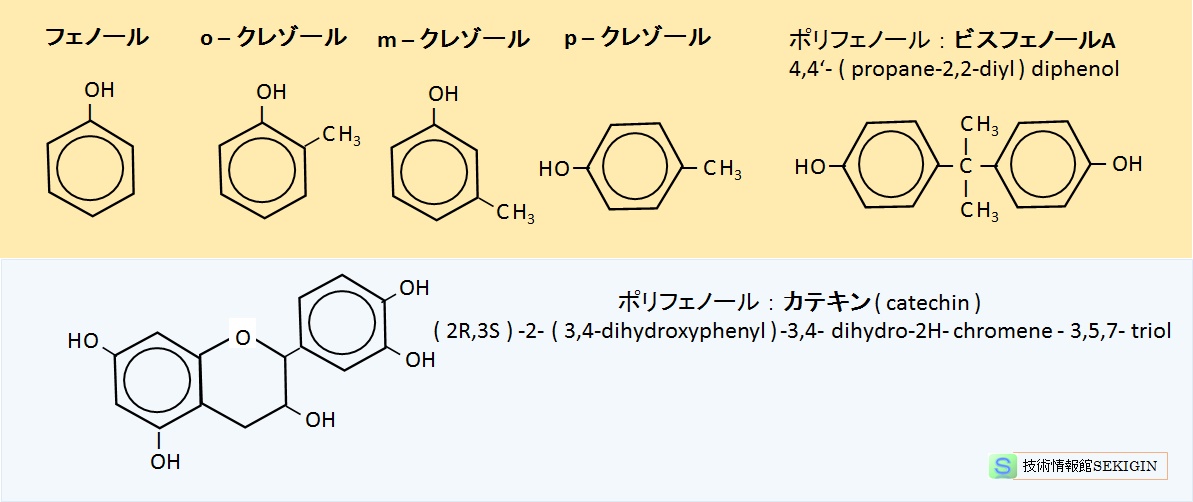
フェノール類の例
ページの先頭へ
主なフェノール類
| 化学式 | IUPAC 名 | モル質量 g/mol |
融点 ℃ |
沸点 ℃ |
備 考 |
|---|---|---|---|---|---|
| C6H5 OH | フェノール phenol |
94.11 | 40.5 | 181.7 | 一価フェノール,ベンゼノール( benzenol ),石炭酸ともいい, フェノール類の中で最も簡単な化合物。水への溶解度 83g /L。 |
| C6H4 (OH)2 | 1,2–ベンゼンジオール benzen -1,2 -diol |
110.1 | 105 | 245.5 | 二価フェノール,カテコール (catechol) ,ピロカテコール (pyrocatechol) , o –ベンゼンジオールとも呼ばれる。水への溶解度 430g /L。 |
| C6H4 (OH)2 | 1,3 –ベンゼンジオール benzen - 1,3 -diol |
110.1 | 110 | 280 | 二価フェノール。レゾルシノール (resorcinol) ,m –ベンゼンジオールとも呼ばれる。 水への溶解度 1400g /L。 |
| C6H4(OH)2 | 1,4–ベンゼンジオール benzen-1,4-diol |
110.1 | 172 | 287 | 二価フェノール,ヒドロキノン (hydroquinone),p –ベンゼンジオールとも呼ばれる。 水への溶解度 73g /L。 |
| C6H3 (OH)3 | 1,2,3–ベンゼントリオール benzen -1,2,3 -triol |
126.11 | 131 | 309 | 三価フェノール,ピロガロール (pyrogallol),焦性没食子酸とも呼ばれ, 写真現像液,染色の媒染剤などで用いられる。 水への溶解度 400g /L。 |
| C6H3 (OH)3 | 1,2,4–ベンゼントリオール benzen -1,2,4 -triol |
126.11 | - | - | 三価フェノール,ヒドロキシキノール(hydroxyquinol)とも呼ばれる。 |
| C6H3 (OH)3 | 1,3,5–ベンゼントリオール benzen -1,3,5 -triol |
126.11 | 218 | - | 三価フェノール,フロログルシノール(phloroglucinol)とも呼ばれ, 医薬品の合成に用いられる。水への溶解度 10g /L。 |
| C6H4 (OH)CH3 | 2-メチルフェノール 2-methyl phenol |
108.14 | 30 | 191 | オルト(o) -クレゾールともいい,3 種の構造異性体がある。 水への溶解度 20g /L。 |
| C6H4 (OH)CH3 | 3-メチルフェノール 3-methyl phenol |
108.14 | 11 | 202.8 | メタ(m) -クレゾールともいい,3 種の構造異性体がある。 水への溶解度 23.5g /L。 |
| C6H4 (OH) CH3 | 4-メチルフェノール 4-methyl phenol |
108.14 | 35.5 | 201.8 | パラ(p) -クレゾールともいい,3 種の構造異性体がある。 水への溶解性 20g /L程度。 |
| (CH3)2 C(C6H4OH)2 | 4,4'-(プロパン-2,2-ジイル) ジフェノール 4,4' -(propane-2,2-diyl) diphenol |
228.29 | 158 | 220 | ビスフェノールA( bisphenol A, BPA )ともいい, ポリカーボネートやエポキシ樹脂などの合成に使われる。 水にはほとんど溶解しない。 |
ページの先頭へ
フェノールの製法
フェノールの合成は,工業的には次に紹介するクメン法( Cumene Process )が用いられる。
実験室的には芳香族アミンの芳香環に直結するアミノ基を,亜硫酸水素ナトリウムで水酸基に変えるブヒャラー反応( Bucherer reaction )などが用いられる。
アルキル置換した簡単なフェノールの合成では,芳香族スルホン酸を水酸化ナトリウムと溶融( 300℃)して得られる。
クメン法
示性式 C6H5CH(CH3)2 の(1-メチルエチル)ベンゼン((1-methylethyl) benzene:慣用名イソプロピルベンゼン,クメン)を酸化してアセトンとフェノールを得る化学合成法である。
はじめに,ベンゼンにプロペンをフリーデル・クラフツ反応で付加反応させ,クメンを製造する。
C6H6 + CH2=CHCH3 → C6H5CH(CH3)2
次いで,これを酸化することでクメンヒドロペルオキシドが得られ,酸で転位させることでアセトン( 2 -プロパノン)とフェノールが得られる。
C6H5CH(CH3)2 + O2 → C6H5C(OOH)(CH3)2 → C6H5OH + (CH3)2CO
同様の経路はトルエンを用いたクレゾールの合成でも用いられる。
ページの先頭へ
フェノールの物性
酸・塩基性
アルコールとフェノールの陽イオン(オキソニウムイオン)は R-OH2+ ,Ar-OH2+ と表される。陰イオンはアルコールの場合の R–O- で表しアルコキシドイオン( alkoxide ion )といい,フェノール類の場合は Ar–O- で表しフェノキシドイオン( phenoxide ion )という。
フェノールからプロトン( H+ )が抜けたフェノキシドイオンは,電子の共鳴で安定化するため,アルコールより強い酸性を示す。
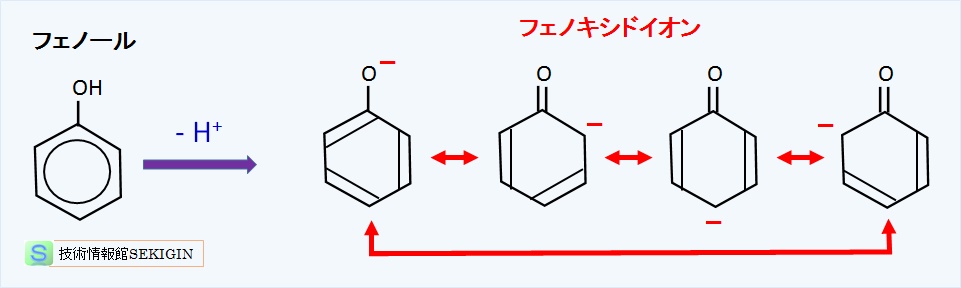
フェノキシドイオン(模式図)
アルコールは,酸性度が低いため弱塩基とは反応せず,強塩基の水酸化ナトリウムなどの金属水酸化物ともわずかしか反応しない。しかし,フェノールの酸性度は高く,希水酸化ナトリウム水溶液に対してもナトリウムフェノキシド( C6H5ONa )の塩を形成して容易に溶解できる。
フェノール類の酸性度は,置換基により大きく変わる。例えば,酢酸( CH3COOH )の pKa≒4.76 であるが,2,4,6–トリニトロフェノール( C6H2(OH)(NO2)3 :ピクリン酸ともいう )は pKa≒0.6と桁違いに強い酸性度を示す。
これは,オルト位やパラ位にニトロ基が置換することで,フェノール類の共鳴関係がさらに安定化するためと考えられる。このように置換基の種類と位置による特性が変化することを置換基効果( substituent effect )という。
ページの先頭へ
置換基効果
置換基効果( substituent effect )
ベンゼンに置換することで,ベンゼンより活性(反応性を高める)にするか,不活性(安定化する)にするかの置換基の効果をいう。
例えば,ニトロ基( –NO2 )は環の反応性をベンゼンより不活性にし,水酸基( –OH )は環の反応性をベンゼンより活性にする。
この影響は,二置換生成物を与える反応,すなわち,すでに置換基が一つ置換されている芳香環に対して,二つ目の置換基が求電子置換を行う場合の反応性,この反応で二つ目の置換基がオルト位,メタ位,パラ位のどこに置換し易いかの配向性は,すでに置換されている一つ目の置換基の効果により異なる。
一つ目の置換基は,反応性と配向性の違いで,
オルト―パラ配向性活性化基( ortho – and para – directing activator )
オルト―パラ配向性不活性化基( ortho – and para – directing deactivator )
メタ配向性不活性化基( meta – directing deactivator )
の 3 種類に分類される。
例えば,水酸基( –OH )は反応性を活性化し,求電子置換でオルト位とパラ位に配向し易いので,オルト―パラ配向性活性化基に分類される。
次には,それぞれの代表的な置換基を反応性の高い順に紹介する。
オルト―パラ配向性活性化基: –NH2 ,–OH ,– H3 ,–NHC(O)CH3 ,–R ,–C6H5
オルト―パラ配向性不活性化基: –F ,–Cl ,–Br ,–I
メタ配向性不活性化基: –CHO ,–C(O)OCH3 ,–C(O)OH ,–C(O)CH3 ,–SO3H ,–CN ,–NO2 ,–N+R3
置換基効果の原理
官能基を構成する原子の電気陰性度と官能基中の結合の極性により,σ結合を通じて電子を供与したり求引したりする作用,例えば,ハロゲン( –X )は官能基とベンゼン環を結ぶπ結合を通じて電子を誘起的に求引し,アルキル基( –R )は誘起的に電子を供与する。
共鳴効果
置換基のp 軌道と芳香環の p 軌道の重なりにより,π結合を通じて電子を供与したり求引したりする作用,例えば,シアノ基( –CN ),ニトロ基( –NO2 )は共鳴効果により芳香環から電子を求引し,ハロゲン( –X ),ヒドロキシ基( –OH )などは,共鳴効果で芳香環に電子を供与する。
三置換ベンゼン
この場合は,異なる二つの置換基の誘起効果と共鳴効果の加成性効果が三つ目の置換基の求電子置換に寄与する。
なお,加成性( additivity , additive property )とは,混合物や化合物のある性質を示す量がそれらを構成する成分の量の和に等しくなる性質をいう。
ページの先頭へ