第五部:有機化学の基礎 脂肪族炭化水素の基礎
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,カルボニル化合物の置換反応に関連し, 【求核アシル置換反応】, 【α置換反応】, 【カルボニル縮合反応】 に項目を分けて紹介し,関連するニトリルの反応,求核付加反応などの概要は別途項目を設けて紹介する。
求核アシル置換反応
求核アシル置換反応( nucleophilic acyl substitution ; NAS )
カルボン酸誘導体( R–CO–Y )が求核剤( Nu : nucleophile )と反応し,別のアシル化合物に変わる置換反応をいう。
求核アシル置換反応には,水と反応してカルボン酸を与える加水分解,アルコールと反応してエステルを与えるアルコーリシス,アンモニアやアミンと反応してアミドを与えるアミノリシス,ヒドリド還元剤と反応してアルデヒドやアルコールを与える還元,有機金属試薬と反応してケトンやアルコールを与えるグリニャール反応などがある。
カルボン酸誘導体( carboxylic acid derivative )
カルボン酸( R–C(O)–OH ),酸無水物( R–C(O)–O–C(O)–R’ ),エステル( R–C(O)–O–R’ ), アミド( R–C(O)-N R’R” ),ハロゲン化アシル( R–C(O)– X :酸ハロゲン化物ともいう),チオエステル( R–C(O)–SR’ ),アシルりん酸( R–C(O)–O–PO32- )などで,置換反応において脱離基として機能(電気的に陰性)できる原子や置換基(緑色で示した部分)にアシル基が結合している。
なお,アルデヒド( R–C(O)–H )の H やケトン( R–C(O)–R’ )の R’ は,脱離基となりえないので求核アシル置換反応は起きない。
求核剤( nucleophile )
求核アシル置換反応の求核剤( Nu )には,アルコキシドやエノラートなどのアニオンやアミンなどの塩基性化合物が用いられる。なお,触媒として酸を用いる反応もある。
アルコキシド( alkoxide )とは,アルコールの共役塩基であるアニオン( R–O- )をいい,エノラート( enolate )とは,α置換反応で紹介するエノール( R–C=C(OH)-R’ )のヒドロキシ基の水素原子が解離したアニオン( R–C=C(O-)–R’ )をいう。
求核アシル置換反応の反応速度は,置換基の脱離段階ではなく,求核剤の付加段階で決まる。なお,一般的には,反応速度はカルボン酸誘導体の立体的条件(立体障害),脱離基の分極程度に依存する。
例えば,立体障害が大きくなる塩化アセチル( CH3C(O) Cl )>塩化プロパノイル( CH3CH2C(O) Cl )>塩化 2–メチルプロパノイル( (CH3)2CHC(O) Cl )>塩化 2 ,2–ジメチルプロパノイル( (CH3)3CC(O) Cl )の順に反応性が低下する。
脱離基の分極程度の影響は,アミド( R–C(O)–H2 )<エステル( R–C(O)–OR’ )<酸無水物( R–C(O)–OC(O)R’ )<ハロゲン化アシル( R–C(O)–X )の順に分極程度が大きくなり反応性も大きくなる。
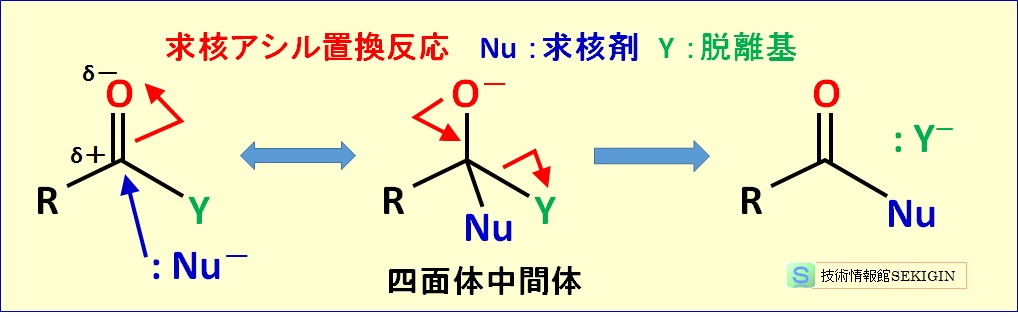
求核アシル置換反応
ページの先頭へ
α置換反応
α置換反応( α- substitution reaction )
カルボニル化合物において,カルボニル基の隣の位置(α位)の水素が,求電子剤( E:electrophile )によって置換される反応をいう。この時,α位の水素をα水素原子という。
求電子剤は,求電子試薬,求電子種ともいわれ,電子の授受を伴う化学反応で電子を受け取る側の化学種を指す。反応機構の説明では, 記号 E や E+ で表記され,陽イオン(H+ ,NO2+ など),分極した分子( HCl ,ルイス酸,ハロゲン化アルキル,カルボン酸ハロゲン化物,カルボニル化合物 など),求核種の接近で分極される分子( Cl2 ,Br2 など),酸化剤,還元剤( BH3 ,Bu2AlH など)などである。
なお,古い文献や教科書に見られる「親電子剤」は,現在の「求電子剤」と同じ意味で用いられている。
互変異性( tautomerism )
カルボニル化合物は,カルボニル基(ケト基ともいう)を持つ化合物である。この中で,α水素原子を持つカルボニル化合物は,アルケンの二重結合の片方の炭素にヒドロキシ基が置換したアルコール,すなわちエノール( enol )と速い速度での平衡状態にある。二つの化合物間の素早い相互変換を互変異性という。なお,カルボニルの状態をケト互変異性体,エノールの状態をエノール互変異性体という。
カルボニル化合物の互変異性は,酸触媒と塩基触媒のいずれの場合も起きる。
酸触媒を用いた時は,初めに酸によりカルボニル基の酸素がプロトン化して,正の電荷を持つ中間体が生成し,次いでα位の水素を水素イオン( H+ )として失うことで中性のエノールを与える。
塩基触媒を用いた場合には,カルボニル基の炭素と酸素の電気陰性度の差に応じて分極した結果としてα位の水素が弱い酸性(β位の水素は酸性にならない)になることで,塩基との相互作用でα位の水素が脱離して負電荷を持つエノラートイオン( enolate ion )が生成する。次いで,カルボニル基の酸素がプロトン化されることで中性の化合物(エノール)を与える。
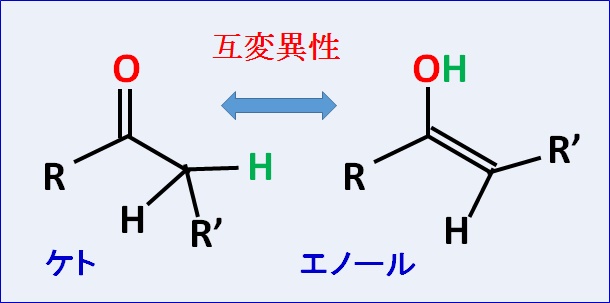
互変異性
α置換反応では,酸触媒を用いたエノールを活用したα位置換反応,塩基触媒を用いたエノラートイオンを活用したα位置換反応が種々ある。
下図の例では,塩基触媒で生成した負電荷のエノラートイオン(求核剤として作用)に求電子剤の強塩基( E+ )が付加する過程を示している。
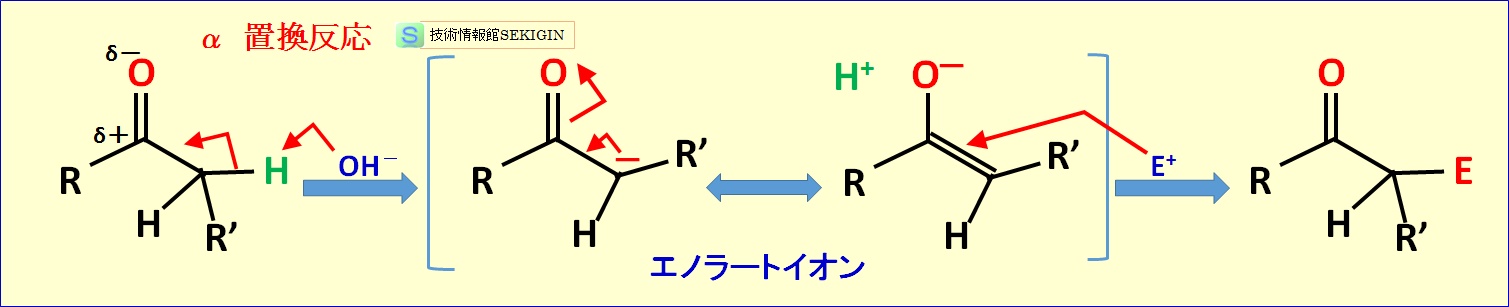
α 置換反応
ページの先頭へ
カルボニル縮合反応
カルボニル縮合反応( calbonyl condensation reaction )
二つのカルボニル化合物の反応をいう。生体内のほとんどの分子(タンパク質,炭水化物,脂質,核酸など)は,カルボニル縮合反応を含む経路で生成されている。
カルボニル化合物は,求核アシル置換反応では求核剤と反応すること,α置換反応では求電子剤と反応することを説明した。すなわち,カルボニル化合物としては,求核アシル置換反応では求電子剤として,α置換反応では求核剤として作用している。
このことは,カルボニル化合物は,求電子剤と求核剤の両方の機能を有していることを示し,これを利用したのがカルボニル縮合反応である。
下図に,水酸化ナトリウムなどの塩基処理した際に,二分子のアセトアルデヒドからヒドロキシアルデヒドが生成する過程を示す。
一般的に,α位に水素を持つアルデヒドを塩基で処理した場合,その生成物はアルデヒド基( –CHO )を持つアルデヒド( aldehyde )とβ位にヒドロキシ基( –OH )を持つアルコール( alcohol )の化合物(β‐ヒドロキシアルデヒド)として得られる。このため,この反応をアルドール反応( aldol reaction :アルドール縮合反応ともいう)という。
アルドール反応は,α水素原子を持つすべてのアルデヒドやケトンの塩基触媒で起きる一般的な反応である。
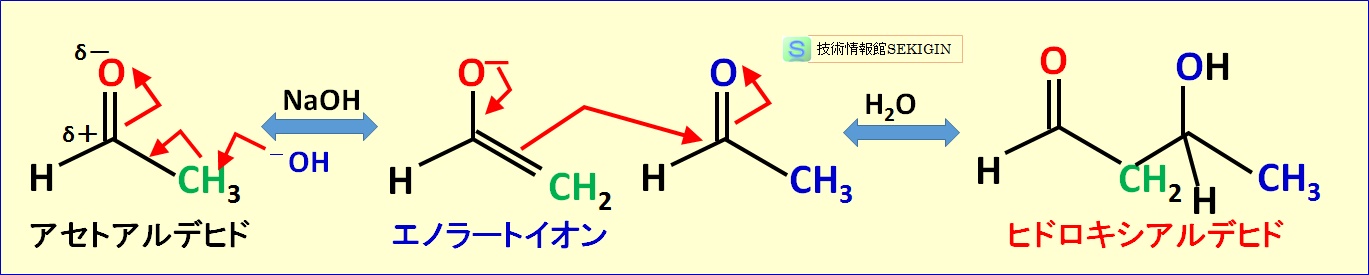
カルボニル縮合反応
ページの先頭へ