第五部:有機化学の基礎 脂肪族炭化水素の基礎
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,二重結合を 2つもつ共役ジエンの特徴に関連し, 【ジエンとは】, 【共役系の安定性】, 【共役ジエンの求電子付加反応】, 【ディールス・アルダー付加環化反応】 に項目を分けて紹介する。
ジエンとは
ジエン( diene )
二重結合を 2つもった炭化水素(一般式 CnH2n-2 )をいう。
なお,3つ以上ある場合はポリエン( polyene )という。なお,1つしかない炭化水素は,既に紹介したアルケンである。
ジエンの分類
ジエンは,不飽和脂肪族の特徴で紹介したように,二重結合の位置と置換基により,次の 4つに分類される。
2つの二重結合の間が 2つ以上の単結合で隔てられた非共役ジエン。
2つの二重結合の間が 1つの単結合で隔てられた共役ジエン。
2つの二重結合が連続(隣接)する集積二重結合。
1つ以上の不飽和炭素原子がヘテロ原子に置換したヘテロジエン。
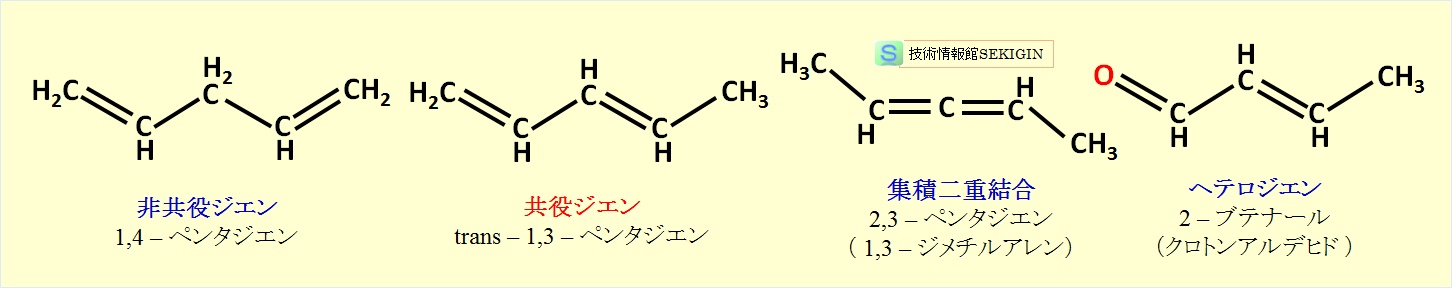
ジエンの分類例
共役ジエン( conjugated diene )
共役ジエンは,共役系( conjugated system )と呼ばれる化合物の一種で,アルケンとは異なる特性を示し,有機化学では共役ジエンは機能的な官能基として扱われる。
なお,共役系とは,不飽和脂肪族の特徴で概要を紹介したように,単結合と多重結合が交互に配置するとき,π軌道の電子が非局在化する軌道系(共鳴混成体)を指す。
ページの先頭へ
共役系の安定性
共役系( conjugated system )
天然ゴムのモノマーとして知られる 2–メチル–1,3–ブタジエン(イソプレン,CH2=C(CH3)CH=CH2 )などの共役ジエンの他にベンゼン環を持つ,芳香族化合物などが知られる。
なお,炭素-炭素結合以外にも,炭素-酸素-炭素結合を持つ環状化合物のフラン( 1–オキサ–2,4–シクロペンタジエン: C4H4O )などや,カルボニル基( C=O ),イミノ基( C=N )を持つ化合物,さらにはグラファイト,導電性高分子材料,ナノチューブなども共役系に分類される。
共役系の水素化熱
共役系は,一般的に分子全体のエネルギーを低下させ,安定性が高まるといわれている。共役によりどの程度安定化するのかは,同じ分子式で,二重結合の位置が異なる非共役ジエンと共役ジエンの水素添加(同じ生成物が得られる)における反応熱(水素化熱)で比較できる。
下図は,非共役の 1,4–ペンタジエンと共役の trans–1,3–ペンタジエンの水素添加反応について,エネルギー変化の模式図である。
ペンタジエンの水素添加反応は発熱反応で,共役系の trans–1,3–ペンタジエンの水素化熱は非共役の 1.4-ペンタジエンより約 27 kJ /mol 低い。すなわち,共役系は,非共役系より低いエネルギー状態にあることが分かる。
共役による分子の安定性は,アルケンの分子構造と安定性で紹介した構造の影響(~10 kJ /mol )より大きい。
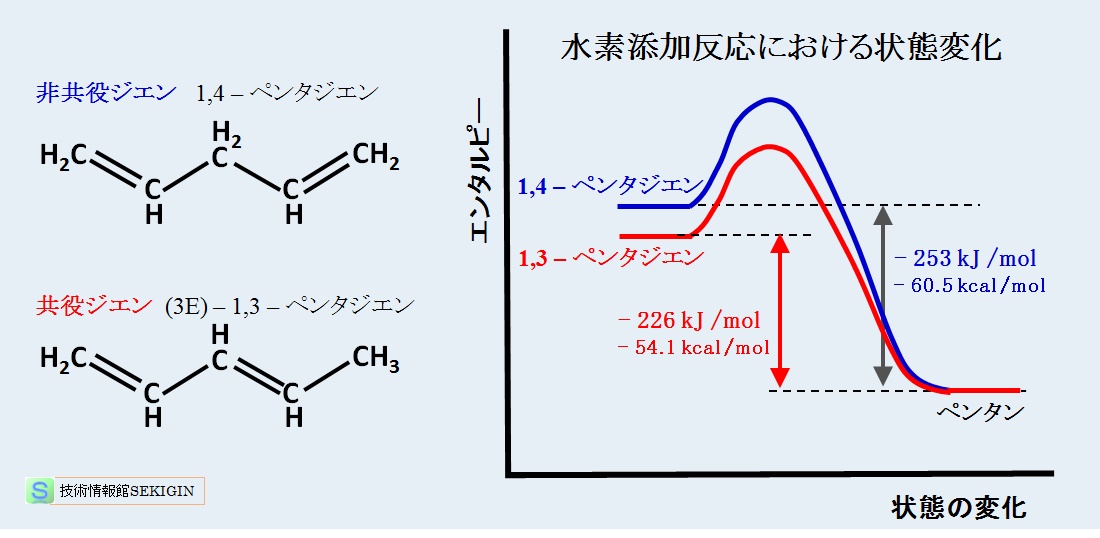
水素化熱の比較
二重結合(非共役)の安定性
分子軌道法で紹介したように,2 つの炭素原子が sp2 混成軌道を形成すると,p 軌道が重なり二つのπ分子軌道に分かれる。
一方のπ分子軌道は初めの p 軌道よりエネルギーが低く,核間を連続する結合性軌道となり,他のπ分子軌道は,エネルギーが高く核間に節をもつ反結合性軌道となる。
これにより,電子は結合性軌道に詰まるため,原子間には安定な二重結合が生じる。
共役系の安定性
共役ジエンは,–C=C–C=C– の構造を持ち,下図に示すように,sp2 混成軌道の炭素原子が 4 つ連続する。この場合のπ分子軌道は 4 つに分裂し,最もエネルギーの低い 4 つの核を連続する結合性軌道(Ψ1 ),4 つの核の中間に節を持ち 2 つ核間を連続する結合性軌道(Ψ2 ),中間の 2 つの核を連続し,両端の核との間に 2 つの節を持つ反結合性軌道(Ψ3*),各核間に節( 3 つ)を持つ最もエネルギーの高い反結合性軌道(Ψ4*)に分かれる。
すなわち,構造式では,中間の結合を単結合として表しているが,電子の非局在化により,いくらかの二重結合性が現れ,非共役ジエンより安定化する。
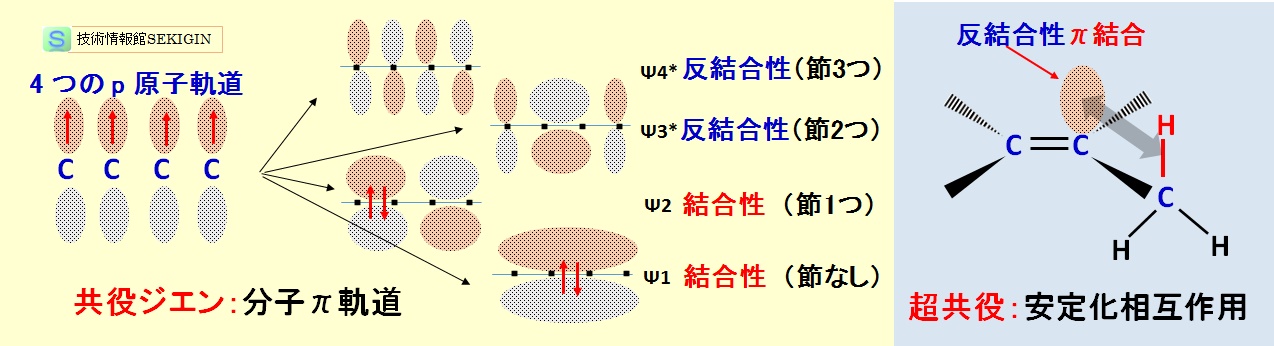
共役ジエンの安定化
超共役( hyperconjugation )とは,2 つのπ結合の相互作用による共役の概念をσ結合とπ結合の間に拡張した概念である。すなわち,二重結合の反結合性のπ軌道と隣の置換基上のσ軌道(通常は C–H 結合)との間における安定化相互作用をいう。
安定化相互作用とは,C–H 結合のσ電子が二重結合の反結合性π軌道の方へと非局在化し,エネルギー準位が低下(安定化)することである。一方,反結合性π軌道のエネルギー準位は逆に上昇して不安定化するため,二重結合が求核剤による攻撃を受けにくくなる。
二重結合の炭素に置換する基が多いほど,超共役になる機会が増えて安定化が進む。
ページの先頭へ
共役ジエンの求電子付加反応
求電子付加反応( electrophilic addition )とは,求電子剤( electrophile )の作用でπ結合が解裂し,新たに 2 つのσ結合を生成する反応である。
一般的にπ結合,YZ 結合エネルギーより C–Y ,C-Z 結合エネルギーが小さい場合が多いので,ほとんどの求電子付加反応は発熱反応である。
【アルケンの特徴】で紹介したように,非共役ジエンやアルケンの求電子付加反応は,–C=C– の電子を求電子剤が奪い,( –CY–C+– + Z- )の中間状態を経由し,–CY–CZ– を形成する。
Y≠Z の場合に,Y が結合する炭素の位置に対し,マルコフニコフ則や逆マルコフニコフ則などと呼ばれる位置選択性が発生する。
一方,共役ジエンの求電子付加反応は,アルケンに見られる位置選択性がなく,常に混合物が得られる。次に,アルケンと共役ジエンの反応例を紹介する。
この要因として,下図に示すように,求電子剤の付加で生成する二つの中間体(アリル型カルボカチオン)と考えられている。なお,カルボカチオンとは,炭素原子上に正電荷を持つカチオン(陽イオン)をいう。
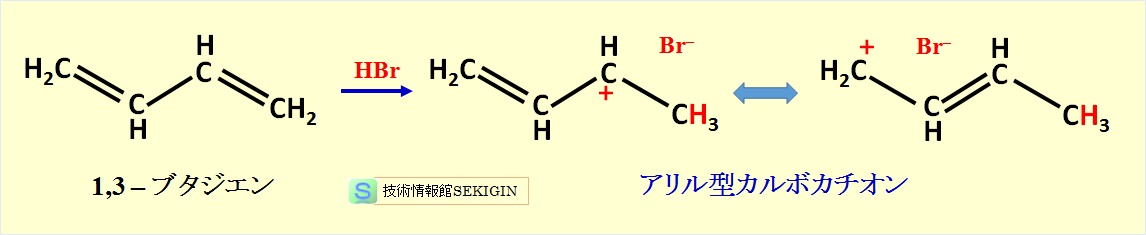
アリル型カルボカチオン
アルケン,非共役ジエン及び共役ジエンのハロゲン化水素付加反応の例を紹介する。
【アルケンの特徴】で紹介したように,アルケンや非共役ジエンの塩化水素( HCl ),よう化水素( HI )の付加は,マルコニコフ則(水素の多い炭素に水素が結合)に従い,臭化水素( HBr )は,過酸化物がない場合は,マルコニコフ則に従い,過酸化物があると水素の多い炭素に臭素が結合(逆マルコニコフ則)する。
アルケンのハロゲン化水素付加反応例
プロペンと臭化水素( HBr )との反応
CH3CH=CH2 + HBr → CH3CH(Br)CH3
非共役ジエンの例
1,4–ペンタジエンと臭化水素( HBr )との反応
H2C=CHCH2CH=CH2 + 2HBr → CH3CH(Br) CH2CH(Br)CH3
共役ジエンの例
1,3–ブタジエンと臭化水素( HBr )との反応
H2C=CH–CH=CH2 + HBr → CH2=CH–CH(Br)–CH3 ,及び CH2(Br)–CH=CH–CH3
生成物として,約 71 %(主成分)の 3–ブロモ–1–ブテン( CH2=CH–CH(Br)–CH3 )と約 21 %の 1–ブロモ–2–ブテン( CH2(Br)–CH=CH–CH3 )の混合物が得られる。
ページの先頭へ
ディールス・アルダー付加環化反応
付加環化反応( cycloaddition reaction )
二つの分子から,同時に二本の C–C 結合ができ,環状生成物が得られる反応である。結合電子の環状の再配分を含む 1 段階で進む反応機構は,ペリ環状反応と呼ばれる。
ディールス・アルダー付加環化反応( Diels – Alder cycloaddition reaction )
付加環化反応の一つで,共役ジエンがアルケンと付加反応を起こして,置換シクロヘキセン誘導体( 6 員環構造)を生じる有機化学反応である。一般的にはディールス・アルダー反応( Diels – Alder reaction )と略して言われる。
この反応は,高い位置選択性および立体選択性を実現できるため,有機合成化学を支える主要な柱の一つとなっている。
ディールス・アルダー反応では,共役ジエンと反応するアルケンを,ジエンを求めて反応する物との意味から,求ジエン体,求ジエン剤,又はジエノフィル( dienophile )と呼ばれる。
ジエノフィルには,求電子性(電子不足)のアルケンを用いるのが一般的であるが,反応によっては,求電子性の共役ジエンなどに対し求核性(電子豊富)のアルケンを用いることもある。
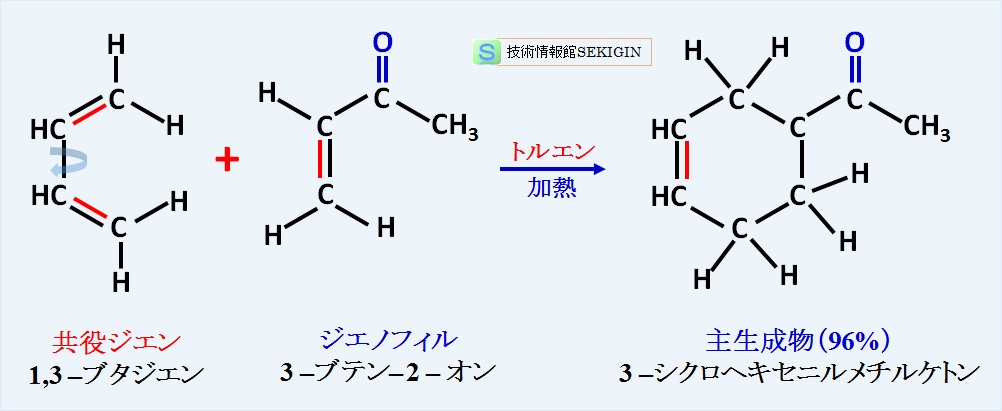
ディールス・アルダー反応例
エチレンを用いた場合には,ディールス・アルダー反応が起きない。すなわち,エチレンはジエノフィルとしては不活性である。このように,反応起きるための条件からジエノフィルには,次の要件が必要となる。
ディールス・アルダー反応では,共役ジエンの電子に占有される最もエネルギーの高い分子軌道(前出の結合性π軌道,Ψ2 )の電子が,熱エネルギーを得てアルケンの分子軌道に送り込むれる。
電子を受け取るアルケンの分子軌道は,電子に占有されていない最もエネルギーの低い分子軌道(前出の反結合性π軌道,Ψ2*)である。
なお,電子に占有される最もエネルギーの高い分子軌道を,最高被占軌道( HOMO : Highest Occupied Molecular Orbital ,ホモ)という。
電子に占有されていない最もエネルギーの低い分子軌道を最低空軌道( LUMO : Lowest Unoccupied Molecular Orbital ,ルモ)という。 一般的に,反応機構の説明に記号 HOMA ,LUMO を用いた解説が多い。
ディールス・アルダー反応が起きる場合は,HOMO と LUMO のエネルギー差が小さいほど,与える熱エネルギーが小さくて済む。すなわち,共役ジエンに電子供与性基(水酸基,メトキシ基,メチル基など)が結合すると HOMO のエネルギー準位が上がり,アルケンに電子求引性基(オキソ基,ニトロ基,ハロゲンなど)が結合すると LUMO のエネルギー準位が下がり,結果としてエネルギーの差が小さくなり,反応が進行しやすくなる。
すなわち,ジエノフィルとして利用できるのは,電子求引性基を持つアルケンである。このようなジエノフィルとして活性が認められるものに,プロペナール( CH2=CHCHO ),2 –ブテン酸メチル( CH3CH=CHC(O)OCH3 ),プロペン酸エチル( CH2=CHC(O)OC2H5 ),無水マレイン酸( 2,5 –ジヒドロフラン– 2,5 –ジオン),アクリロニトリル(プロペンニトリル: CH2=CH–C≡N ),1,4–ベンゾキノン(シクロヘキサ– 2,5 –ジエン– 1,4 –ジオン)などが知られている。
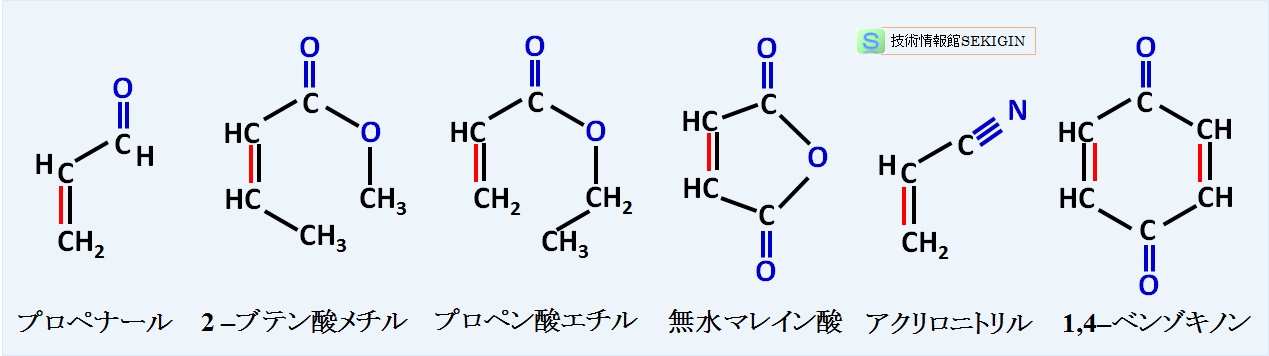
ジエノフィルの例
ページの先頭へ