第五部:有機化学の基礎 アルコール・カルボン酸
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,カルボン酸以外のカルボニル化合物に関連し, 【カルボニル化合物とは】, 【ニトリルの反応】 に項目を分けて紹介し,関連する求核付加反応,置換反応などの概要は別途項目を設けて紹介する。
カルボニル化合物とは
カルボン酸をはじめ,カルボニル基( >C=O :carbonyl group )を持つカルボン酸誘導体,アルデヒド( R–CHO ),ケトン( R–C(O)–R’ )などの化合物をカルボニル化合物という。
カルボニル化合物は,基本的に R–C(O)–R’ (アシル基という)の構造を持つ。
カルボン酸誘導体( carboxylic acid derivative )
一般的に,カルボン酸の水酸基が金属以外のヘテロ原子( hetero atom )と結合した化合物をいい,酸無水物( R–C(O)–O–C(O)–R' ),エステル( R–C(O)–O–R' ), アミド( R–C(O)–NR'R" ),ハロゲン化アシル( R–C(O)–X )が挙げられる。
ヘテロ原子とは,有機化学の分野で,炭素と水素以外の原子の総称をヘテロ原子という。なお,反応性の類似するニトリル( -C≡N )もカルボン酸誘導体に分類される。
アシル基( acyl group )
アシル基の R は,アルキル(飽和脂肪族炭化水素),アルケニル(二重結合を持つ脂肪族炭化水素),アルキニル(三重結合を持つ脂肪族炭化水素),又はアリール(芳香族炭化水素)のいずれでもよく,アシル基の一方の置換基 R' には,炭素,水素,酸素,ハロゲン,窒素,硫黄などの原子,化合物が可能である。
カルボニル化合物の分類
カルボニル化合物は,反応性の違いで二つのグループに分けられる。一方は,アルデヒドとケトンである,他方はカルボン酸とその誘導体である。
アルデヒドのアシル基に結合している原子( H ),ケトンのアシル基に結合している原子( C )は,負の電荷を安定化させられないので,置換反応において,脱離基になることができない。
一方,カルボン酸,酸無水物,エステルでは酸素( O ),アミドで窒素( N ),ハロゲン化アシルではハロゲン( X )がアシル基に結合している。これらの原子は,負の電荷を安定化させることができるので,求核アシル置換反応で紹介するように,置換反応において脱離基になることができる。
【参考】
カルボニル基の炭素原子は, sp2 混成軌道を採り,3 つのσ結合と 1 つのπ結合を形成し,平面三角形に配置される。酸素の電気陰性度が炭素より大きいので,C = O が分極し,双極子モーメントを持つとともに,酸素原子がわずかに負を帯び,炭素原子が正を帯びる。これにより,カルボニル基の炭素原子が求電子的性質を発揮できる。
ページの先頭へ
ニトリルの反応
前節では,カルボン酸の製造で,強酸又は強塩基水溶液中でニトリル( -C≡N )を加熱することで,加水分解によりアミドを経由してカルボン酸が生成することを紹介した。これを簡単化して示すと次のようになる。
R–C≡N + H3O+ →(R–C(O+H)NH2)+ H2O → R–C(O)OH + NH4+
この方法では,炭素数がニトリル製造に用いた出発物質より 1つ多いカルボン酸が生成される。
すなわち,ニトリルの製造では,多くの場合,ハロゲン化アルキル( R–CH2X )とシアン化物イオン( CN- )との間の求核置換反応( SN2 反応)が利用される。
R–CH2X + CN- → R–CH2CN + X-
この方法は,第一級ハロゲン化物で最も有効となる。
アミノ酸製造で用いられるアミノニトリルの生成と加水分解は,ストレッカー反応( Strecker reaction )といわれる。
第二級ハロゲン化物や第三級ハロゲン化物を用いると,競合反応として,分子内脱水によるアルケンの生成で知られる二分子脱離反応( E2 反応)が起きるため,立体障害の少ない化合物に限られる。例えば,関節炎などの治療薬(フェノブロフェン)の合成に用いられている。
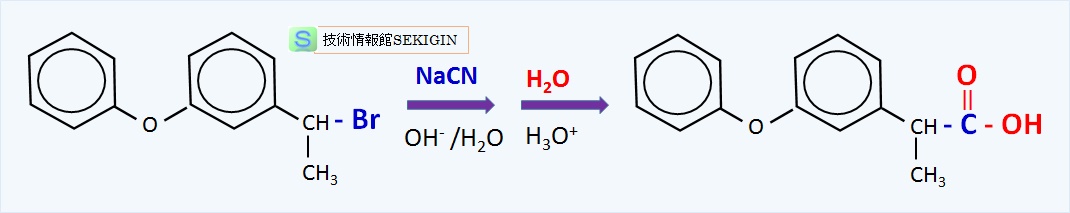
フェノブロフェンの合成(概要図)
【参考】
求核置換反応( nucleophilic substitution reaction )
反応中心の求電子剤に求核剤が攻撃し,脱離基の脱離反応。生成物は,結合物(求電子剤と求核剤)と脱離基となる。脂肪族炭素の求核置換反応には,反応の形態によって SN2反応,と SN1反応 などがある。芳香族炭素の求核置換反応は芳香族求核置換反応,カルボン酸誘導体の求核置換反応は求核アシル置換反応ともいう。
ページの先頭へ