第一部:化学と物質構造・化学結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,分子間力の要因として,【双極子とは】, 【双極子モーメント】, 【双極子モーメントの単位】 に項目を分けて紹介する。
双極子とは
双極子( dipole )とは,分子内に生じた電子の偏りを原因として発生する電荷のひずみである。すなわち,分子構造の中で,正の電荷の重心と負の電荷の重心が一致しない電荷の配置を双極子という。
【共有結合】で解説するが,分子内結合では,電子対(スピンの異なる 2 個の電子)が原子間で共有(共有電子対という)されている。この電子対の分布状態により分子内の電荷の偏りが生じる可能性がある。次に分子種別に共有電子対の分布について考察する。
共有電子対の偏りは,先に解説した電気陰性度の違いで推定できる。

二原子分子の分極
二原子分子
二原子分子には,同種元素による場合と異種元素による場合がある。
HCl など異種元素による二原子分子では,それぞれの原子の電気陰性度が異なる。
このため,共有電子対は電気陰性度の大きい原子に引き寄せられ,わずかに負の電荷(δ-)を帯び,電気陰性度の小さい原子は,わずかな正の電荷(δ+)を帯びる。このような分子内に正電荷と負電荷の重心が一致しない分子を極性分子( Polar molecule )という。
一方で,H2 や Cl2 のように同種元素による二原子分子では,共有電子対は双方の原子に均等に共有されるので,電荷の偏りは生じない。このような分子を無極性分子( nonpolar molecule )という。
化学式(構造式)の中での極性を表示する場合には,わずかな負の電荷の位置に“δ- ”,わずかな正の電荷の位置に“δ+ ”を添えるのが一般的である。
なお,δは数量の大小を示すものではなく,ゼロではないことのみを意味している。
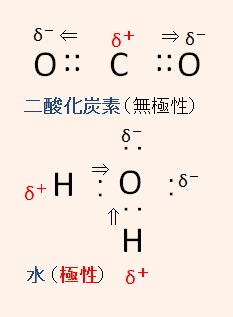
多原子分子の分極
多原子分子
複数の原子で構成される多原子分子では,原子間の共有電子対の分布状態に加えて,分子構造も双極子に影響する。
すなわち,共有電子対の偏りが複数生じても,二酸化炭素( CO2 )のように構造の対称性により,正の荷電の重心と負の荷電の重心が一致する場合には,偏りの影響が互いに打ち消しあい,分子としては極性のない無極性分子となる。
一方,分子構造が,水( H2O )のような折れ線形など正の荷電の重心と負の荷電の重心がずれている場合には,極性分子となる。
極性の大きさは,原子間の電気陰性度の差と重心のずれの程度に依存する。
【参考】
電気陰性度( electronegativity )
化学結合にあずかる電子(共有電子対)を引き寄せる力の強弱を表す尺度である。
一般的には,電気陰性度の小さい元素は,陽性が強く(陽イオンになり易い),大きい元素は,陰性が強い(陰イオンになり易い)と考えてよい。
電気陰性度の尺度を決める方法が種々提案されている。 この中で,広く用いられているのは,二原子分子の解離エネルギー,共有結合エネルギー,イオン結合エネルギーなどから求めたポーリング提案の値である。
ページのトップへ
双極子モーメント
極性分子において,双極子の程度を比較する場合に,双極子モーメント( dipole moment )(方向ベクトルと大きさの積)を用いる。
双極子モーメントμは,電荷の大きさδ,電荷の正と負の重心間の距離γとすると,
μ = δ ・ γ
で与えられる。
双極子モーメントの単位は,デバイ D( debye )が用いられる。
双極子モーメントの計測例
コンデンサーの電極間に極性分子をはさみ,電場を与えた時に,分子のプラス側がコンデンサーの負極の方に,マイナス側が正極の方を向くように配列しようとする。すなわち,対象とする分子を用いたコンデンサーの誘電率を計測することで,双極子モーメントを求めることができる。
ハロゲン化水素の双極子モーメントの実測値(単位 D )は,フッ化水素( HF ): 1.82 ,塩化水素( HCl ): 1.11 ,臭化水素( HBr ): 0.83 ,ヨウ化水素( H I ): 0.45 である。この値から,概して,電気陰性度の差の大きいものほど双極子モーメントも大きいことが分かる。
実測値の意味するもの?
電子の電荷は,電気素量( elementary charge :陽子 1個の電荷: 1.602176565 × 10-19 C )と同等と扱えるので,核間距離約 1.27 × 10−10 m の塩化水素( HCl )の結合が 100%イオン性(水素の電子が完全に塩素原子に移動)と仮定すると,双極子モーメントは,
( 1.602176565 × 10-19 ) × (1.27 × 10-10 ) ÷ (3.335641×10-30 ) ≒ 6.1 ( D )
となる。
一方,実測した塩化水素の双極子モーメントは,約 1.1 ( D ) である。計算値との違いは,結合のイオン性の見積もりの違いと考えることができる。
すなわち,塩化水素の結合の約 18% ( 1.1 ÷ 6.1 ≒ 0.18 ) が電荷の偏りによるイオン結合性で,残りの 82%が共有結合性であると考えることができる。
ページのトップへ
双極子モーメントの単位
双極子モーメントの単位 デバイ( debye ) D は, SI単位系として認められていないが,物理学,化学の分野では,高等学校教育を含めて広く使用されている。なお,単位名は,物理学者デバイ(1884年 ~ 1966年)に因んで命名されている。
デバイ(D)は,原子の長さと電気素量(電荷素量)の関係を考慮し,原子の長さのオーダー( Å:10-8 cm ),電気素量の静電単位系のオーダー( 10-10 emu )の積から,1D = 10-18 esu・cm と定義された。
後述するように,SI 単位系では,電気素量 1esu ≒ 3.335641 × 10-10 C (クーロン)なので,1D ≒ 3.335641×10-30 C・m と非常に小さい値になる。このため,直観的に分かり易いデバイ( D )が双極子モーメントの単位としていまだに広く用いられている。
電気素量( elementary charge )
素電荷(elementary charge),電荷素量とも呼ばれ,電気量の単位となる記号 e で表される物理定数で,陽子 1個の電荷,電子の電荷の符号を変えた量に等しい。
電気素量( CODATA 2018 ) e = 1.602 176 634 × 10-19 C(クーロン)
電気素量(静電単位系) e = 4.803 204 673(30) × 10-10 esu
CODATA 2018とは,国際学術会議( International Science Council : ISC )の科学技術データ委員会( Committee on Data for Science and Technology )発表の基礎物理定数表 2018年版に掲載された推奨値を意味する。
電気素量の換算 1esu ≒ 3.335641 × 10-10 C
静電単位 esu ( electrostatic unit )は,CGS単位系の電気量の単位で,スタットクーロン( statcoulomb, 記号 statC )とも言われ,真空中に 1cm の間隔で置かれた互いに等しい電気量の間に働く力が 1ダイン( dyn = 10-5 N )であるときの電気量をいう。
クーロン( C: coulomb )は,国際単位系( SI )の電荷の単位で,1A (アンペア)の電流が 1秒間流れたときに運ばれる電気量と定義される。
スタットクーロン( statC )の値をセンチメートル単位の光速度の値 c(無次元)で除すると,CGS電磁単位系の電荷の単位アブクーロン( abC )になる。アブクーロンは SI単位系の電荷の単位であるクーロン( C )の 10倍に相当するので,スタットクーロンとクーロンの換算は以下のようになる。
1statC = 10abC/C × (1/c) statC/abC ≒ 3.335641×10-10 C
ボーア半径( Bohr radius )
なお,原子の長さの単位として用いられるボーア半径( a0 )を用いると,ボーア半径と電気素量の積 ≒ 2.54D となる。
ボーア半径は,デンマークの理論物理学者ボーアの原子理論(古典的量子論)における水素原子の第一軌道半径と定義し,原子の長さの単位として用いられる。
水素原子の基底状態で,電子が原子核(陽子)のまわりを円運動していると仮定すると,その半径( a0 )は次式で表される。
a0 = ( h/2π)2 /( mee2 )
ここに,h :プランク定数,me :電子の質量,e :電気素量
プランク定数( CODATA 2018 ) h = 6.626 070 15 × 10-34 Js = 4.135 667 696... × 10-15 eVs
電子質量( CODATA 2018 ) me = 9.109 383 7015(28) × 10-31 kg
ボーア半径( CODATA 2018 ) a0 = 0.529 177 210 903(80) × 10-10 m
CODATA 2018とは,国際学術会議( International Science Council : ISC )の科学技術データ委員会( Committee on Data for Science and Technology )発表の基礎物理定数表 2018年版に掲載された推奨値を意味する。
【参考】
クーロン( Charles-Augustin de Coulomb )
シャルル=オーギュスタン・ド・クーロン(1736年 ~ 1806年)は,フランスの物理学者で,帯電した物体間に働く力を測定からクーロンの法則を発見した。業績に因んで,電荷の単位に「クーロン」が用いられている。
デバイ( Peter Joseph William Debye )
ピーター・ヨセフ・ウィレム・デバイェ(1884年 ~ 1966年)は,オランダの物理学者,化学者で,デバイ温度,電気双極子モーメントの単位(デバイ),デバイモデル,デバイ-ヒュッケルの式などで知られる。
ボーア( Niels Henrik David Bohr )
ニールス・ヘンリク・ダヴィド・ボーア(1885年~1962年)は,デンマークの理論物理学者。量子論の育ての親。
ページの先頭へ