第一部:化学と物質構造・化学結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学結合の表記法について,【組成式,分子式,示性式】, 【構造式(電子式)】 に項目を分けて紹介する。
組成式,分子式,示性式
物質を元素組成で表現する表記法を化学式( chemical formula )という。イオン物質を表す化学式は,イオン式( ionic formula )とも呼ばれる。
化学式は,分子構造の詳細をどの程度まで表現するかで,組成式( empirical formula ),分子式( molecular formula ),示性式( rational formula ),構造式( structural formula ),電子式( electronic formula )を使い分ける。
組成式
組成式は,食塩(塩化ナトリウム)などのイオン結合物質,金属や巨大分子などの,原子の配置が単純な繰り返しで,化学構造の違いを区別する必要が無い場合に用いられ,原子の組成(比率)のみで表記するものである。
組成式を用いる適切な例としては,ダイヤモンド( C )や石英( SiO2 二酸化ケイ素)などの網目状構造の共有結合性物質,塩化ナトリウム( NaCl )などのイオン結合性物質や金属結合性物質である。
分子式
分子式は,分子に含まれる原子とその個数を的確に示す場合に用いるが,分子の一部が化学特性に大きく関わる場合には,示性式や構造式による表記が望ましい。
特に,有機化合物など小分子の共有結合性物質は,組成式で表示するのは好ましくない。
下表の例に示すように,組成式と分子式とでは,分子によっては異なる表記となる。しかしながら,意外に混用する例が多いので注意すること。
示性式
構造が単純で構造的な紛らわしさが無い場合には,官能基などの結合関係を示す示性式で表現される。化学反応の表記に示性式を用いる場合が多い。
| 化合物名 | 組成式 | 分子式 | 示性式 |
|---|---|---|---|
| メタン | CH4 | CH4 | CH4 |
| エタン | CH3 | C2H6 | CH3CH3 |
| プロパン | C3H8 | C3H8 | CH3CH2CH3 |
| ブタン | C2H5 | C4H10 | CH3CH2CH2CH3 ( n - ブタン)
CH3CH (CH3) CH3 ( iso - ブタン) |
| メタノール | CH4O | CH4O | CH3OH |
| エタノール | C2H6O | C2H6O | CH3CH2OH |
| プロパノール | C3H8O | C3H8O | CH3CH2CH2OH ( 1 - プロパノール)
CH3CH (OH) CH3 ( 2 - プロパノール) |
| 五酸化リン | P2O5 | P4O10 | - |
| 四酸化三鉄 (マグネタイト) |
Fe3O4 | FeO・Fe2O3 | - |
【参考】
分子( molecular )
2つ以上の原子( atom )から構成される電荷的に中性な物質を指す。分子には,酸素( O2 )など 定まった数の原子で構成される分子から,金属,ダイヤモンドのように,原子数に定めがなく,物質そのものが一つの分子(巨大分子)のものまである。
特異な例としては,ヘリウム ( He ),ネオン ( Ne ),アルゴン ( Ar )などの希ガス元素は,単原子で安定して存在できるので単原子分子などとも呼ばれる。
化学結合( chemical bond )
分子や化合物の中で原子同士を結び付けている力である。原子同士を結び付ける力は,原子の周りの電子の挙動で決まる。
分子内結合には,共有結合,配位結合がある。集団を形成する結合には,イオン結合,金属結合,水素結合(分子間力),ファンデルワールス結合(分子間力)がある。
ページのトップへ
構造式(電子式)
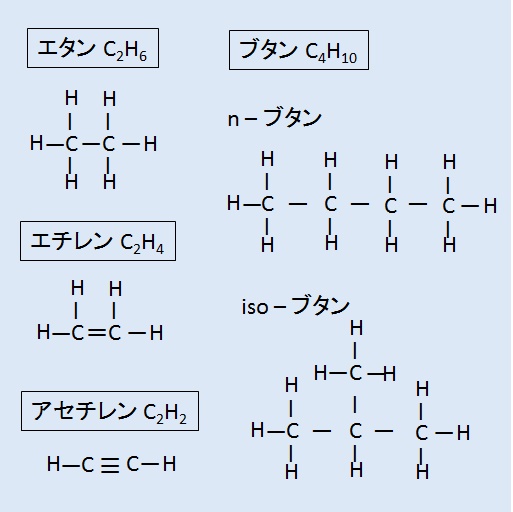
例 分子式と構造式
構造式の書き方に,規定された方法はないが,分子を構成する原子の結合状態を平面的に描くのが一般的である。
結合状態の表記は,共有電子対を価標(bond :線の数で単結合,二重結合,三重結合を表現する)で表示するものと,共有電子対をコロン(単結合 :,二重結合 :: ,三重結合 ::: )で表示するものがある。
価標で表示するのが一般的で,コロンで表示する場合は,電子式(ルイス構造式)といい,ラジカル反応などの化学反応での電子のやり取りなどを特に示したい場合などに用いられている。
分子の構造が複雑な場合は,炭化水素部分の水素原子や炭素原子を省略し,価標のみで作図(折れ線)される場合も多い。
文献や専門書等では,省スペースのため,構造式の骨格となる炭素を省略して価標の折れ線で表示したり,部分構造の基‐CH3 を ‐Me ,‐C ( = O )OHを ‐COOHなど略号を用いたりするなど,多くの省略形を用いることがある。
【参考】
ルイス構造式( Lewis structure formula )
アメリカの物理化学者ギルバート・ニュートン・ルイス( 1875 ~ 1946 )が1916年に共有結合の発見で提唱した構造式。
構造式の結合状態の表記には,共有電子対を価標( bond :線の数で単結合,二重結合,三重結合を表現する)で表示するものと,共有電子対をコロン(単結合 : ,二重結合 :: ,三重結合 ::: )で表示するものがある。
価標で表示するのが一般的で,コロンで表示する場合は,電子式(ルイス構造式)といい,ラジカル反応などの化学反応での電子のやり取りなどを特に示したい場合などに用いられている。
ギルバート・ニュートン・ルイス( Gilbert Newton Lewis )
アメリカ合衆国の物理化学者( 1875 ~ 1946年)で,共有結合の発見(ルイスの電子式),ラジカル(不対電子対)の定義,酸・塩基の定義(ルイス酸・塩基),熱力学の再構築による化学熱力学の提唱,光化学実験,光子( photon )の命名などで知られる。
ページの先頭へ