第一部:化学と物質構造・共有結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,共有結合の分子軌道について,【混成軌道とは】, 【共有結合による巨大分子】 に項目を分けて紹介する。
混成軌道とは
電子軌道の混成
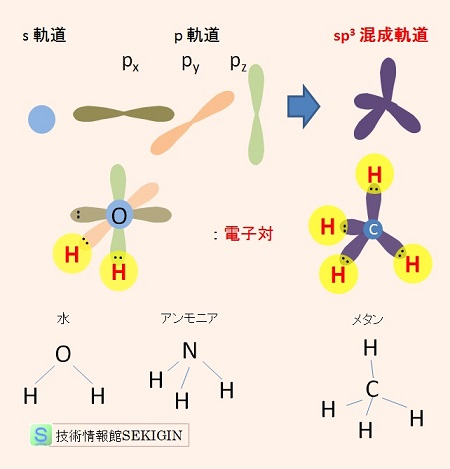
一方,化学結合では,それぞれの原子の場合の不対電子の軌道を保つ必要は必ずしもなく,原子間の化学結合の形成に有利なように,不対電子の複数の軌道が再構成され,形成した軌道を混成軌道( hybrid orbital )という。
ここでは,炭素( C )は,3つの p軌道に 2個の不対電子しかないが,メタン( CH4 )で知られるように,4個の水素と共有結合できる理由を混成軌道を用いて解説する。
詳細は省略するが,これは,最外殻の s軌道の電子 1個が空の p軌道に移動(昇位:promotion )し,s 軌道と 3つの p 軌道の混合(混成軌道: hybrid orbital )が起こり, 4個の不対電子を持つ sp3 混成軌道(四面体形)と呼ばれる新しい軌道が形成されたためである。
これにより,不対電子 1個を持つ 4つの軌道は,4個の水素と共有結合でき,四面体の重心と各頂点に原子を配置した構造をとることができる。
同様に,電子の昇位で形成される混成軌道には,sp混成軌道(直線),sp2 混成軌道(平面三角形),sp3 混成軌道(正四面体形)がある。
d軌道電子を持つ元素では,dsp2 混成軌道(平面正方形),dsp3 混成軌道(三角双錐形),d2sp2 混成軌道(四角錐形:ピラミッド形),d2sp3 混成軌道(八面体形),d4sp 混成軌道(三方柱形),d4sp3 混成軌道(三角十二面体形)など多種の混成軌道を形成できる。
ページのトップへ
共有結合による巨大分子
巨大分子とは,化合物全体が一つの分子,即ち特定の分子が存在しない物質である。これを,化学式で表す時には組成式( empirical formula )でしか表せない。
巨大分子の多くは,よく知られるイオン結合の塩や金属の結晶であるが,共有結合においても,3次元網目状に結合が進むことで巨大分子になる。
共有結合の巨大分子の例として,炭素( C )の同素体( allotrope ),及び二酸化ケイ素( SiO2 )の高分子化合物を次に紹介する。
炭素の同素体
ダイヤモンド( diamond )
炭素原子が sp3 混成軌道で結合した正四面体形の三次元立体構造を有している。すなわち,1個の炭素が 4個の価電子を使い 4個の炭素原子と共有結合している。この構造のため,ダイヤモンドは最も硬く(モース硬度 10 ,ビッカース硬度 70~150GPa ),高融点(通常の条件では黒鉛化や分解,高圧下で 3550℃),熱伝導性が非常に高く,電気の不導体である。また光の屈折率が大きく無色透明な物質である。
黒鉛( graphite )
炭素原子が sp2 混成軌道で結合した平面の正六角形が連なった層状構造をしている。すなわち,1個の炭素が 3個の価電子を使い 3個の炭素原子と共有結合し,残りの価電子 1個が金属結合のように挙動(半金属的)する。
黒鉛は,電池の電極に用いられるほどの電気の良導体(電気伝導率 106S/m 程度:断面積 1mm2 で長さ 1m の抵抗 1Ω)で,融点が高い( 36気圧,3370℃で昇華)黒色の物質である。また,層状構造同士は,弱いファンデルワールス力で結合しているため,外力を加えると層状に容易にはがれる(へき開完全)。
その他の炭素同素体
黒鉛と同様の sp2 混成軌道で結合する同素体にフラーレン類(サッカーボール状の炭素),カーボンナノチューブなどがある。また,sp2 混成軌道,sp3 混成軌道の混合型に非結晶形のカーボンブラック(無定形炭素)がある。
ケイ素の化合物
二酸化ケイ素化合物
二酸化ケイ素で構成される物質を総称してシリカ( silica )という。シリカは圧力や温度で様々の形をとり,石英やクリストバル石(方珪石)などの結晶性シリカ,オパールやシリカゲルなどの非結晶性シリカに分けられる。
なお,石英ガラスは,光ファイバーなど光学用途,照明用途を目的に,石英を溶融・冷却や化学合成などで人為的に作った非結晶性シリカである。
石英( quartz )
石英(水晶)は,1個のケイ素原子に 4個の酸素原子が共有結合している。構造は,ダイヤモンドの炭素をケイ素に置き換え,ケイ素とケイ素の間に酸素を配した正四面体形の三次元立体構造である。
石英は硬く(モース硬度 7 ),融点が高く(限定条件で 1713℃),電気不導体の無色透明な物質である。
【参考】
組成式( empirical formula )
イオン結合物質,金属,巨大分子など,化学構造の違いを区別する必要が無い場合に,原子配置の繰り返し単位となる原子の組成(比率)のみで表記する。
同素体( allotrope,allotropism )
同一元素の単体であるが,構成する原子の配列(結晶構造),結合の仕方が異なり,異なる性質(物理的,化学的)を示す単体同士の関係をいう。身近な例として,炭素元素( C )の配列(結晶構造)の異なるダイヤモンドと石墨(グラファイト),酸素元素( O )の結合様式の異なる酸素( O2 )とオゾン( O3 )などがある。
ページの先頭へ