腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
鋼腐食の基礎
鋼の局部腐食(異種金属接触腐食)
異種金属接触腐食(galvanic corrosion)
異種金属が直接接続(電気的に)されて,両者間に電池が構成された時に生じる腐食をいう。
異種金属接触腐食の原理は,「腐食と電気化学」で例示したダニエル電池(Daniel cell)そのものである。
ダニエル電池では,亜鉛と銅を電解液に浸漬し,両金属を導線で連結することで,電気エネルギーを得ている。
この電気エネルギーは,亜鉛の腐食で発生した電子に依存する。亜鉛は対極である銅よりが卑な金属である。
すなわち,異種金属接触腐食は,曝される環境下での電極電位(electrode potential)の異なる金属同士が接触した場合に起きる。
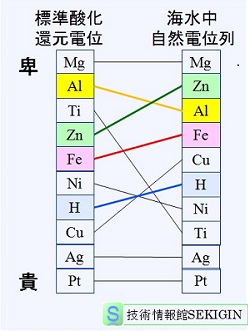
海水中の自然電位列
異種金属が接触した場合に,何れの金属で腐食促進が起きる可能性については,使用環境における金属の電極電位を比較することで容易に予測できる。
電極電位は,曝される環境で異なる。このため,問題となる環境での電位(自然電位)を計測する必要がある。一般的には,炭素鋼は,概ねでステンレス鋼,銅との接触では,多くの環境で炭素鋼の卑な自然電位となる。このため,これらの金属との接触では,異種金属接触腐食による局部腐食の危険性が高い。
異種金属接触腐食の可能性と程度は,異なる要因に支配されるので注意が必要である。
すなわち,腐食の程度は,金属間の電位差のみでは推定できず,周辺構造と環境条件を考慮しなければ推定できない。
例えば,海水中で電極電位が卑な鋼(Fe)が貴な銅(Cu)と接触している場合を考える。ここで,腐食速度が溶存酸素の拡散速度で律速される基本条件に従うと仮定する。この場合には,酸素の消費速度は,金属の表面積に比例することになる。
すなわち,酸素の大部分は,カソードとなる銅表面で消費されるので,銅と鉄の面積比の影響を大きく受ける。
「異種金属接触腐食の程度」で例示したように,面積比により,鉄の腐食程度は
実用面では,異種金属の面積比以外に
◎ 接触する水の導電性(影響の及ぶ面積が変わる)
◎ 接触する水膜の厚み(影響の及ぶ面積が変わる)
◎ 接触する水のpH(酸性では,水素発生型腐食になる)
◎ 金属の種類(特に,アルミニウムは大きい影響を受ける)
の影響も大きい。
鋼橋では,同一金属でも部分的に電位の異なる個所が発生する次の場合も注意が必要である。
● 不適切な溶接で溶接部と母材間に電位差が生じた場合,不適切な溶接部がアノードになる。
● 1960年代以前の鋼橋では,ミルスケール(黒皮)鋼板を用いているので,部分的にミルスケールに損傷を受けた個所がアノードになる。
【参考】
電極(electrode)
電気化学では,広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。【JIS K 0213「分析化学用語(電気化学部門)」】
電極を示す名称には,カソード・アノード,正極(+極)・負極(-極),陰極・陽極などの名称が使われている。特に,陰極・陽極の用語は,技術分野で示す意味が異なり,混乱した使用例が見られるので,注意が必要である。
なお,カソード(cathode)は還元反応を生じる電極,アノード(anode)は酸化反応を生じる電極をいう。
電極電位(electrode potential)
JIS K 0213 「分析化学用語(電気化学部門)」では
a ) 電極が溶液相などのイオン伝導体相と接しているとき,後者の内部電位に対する前者の内部電位。注記:この値を直接実測することは不可能である。
b ) 注目している電極系を,ある参照電極と組み合わせてガルバニ電池を構成させたとき,注目する電極に取り付けた金属端子の内部電位から,参照電極に取り付けた同種の金属端子の内部電位を差し引いた値。
すなわち,電極電位の絶対値を測定することは不可能で,知ることができるのは,基準とした電極との電位差である。
標準酸化還元電位(standard redox potential ,standard oxidation-reduction potential)
反応に関与する全ての化学種の活量が 1で,平衡状態にある時の熱力学的に求まる理論値である。
ギブズエネルギー変化⊿rG0 に対応する電位 E0 と定義される。
⊿rG0 = - zFE0
ここで,z :酸化還元反応で授受される電子数,F :ファラデー定数( 96,485 C mol-1 )
一般的には,標準電極電位(standard electrode potential),標準電位(standard potential),標準還元電位(standard reduction potential)とも呼ばれる。
標準電位列(electromotive force series)とは,金属の標準電極電位を,その大きさの順位並べ,金属のイオン化傾向及び一部の非金属元素の電気化学的酸化反応傾向の大きさの順を示した列。電気化学列ともいう。【JIS Z0103「防せい防食用語」】
ページトップへ