腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食と化学反応に関連し, 【腐食し易さとは】, 【主な用語】 を紹介する。
腐食の開始と継続
腐食し易さとは
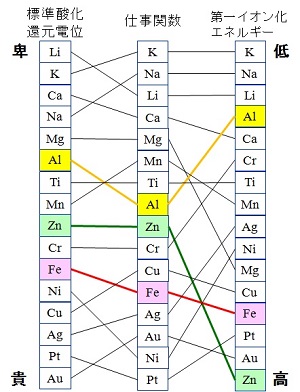
金属のイオン化 定義の違いによる順位比較
右図には,主な金属元素の標準酸化還元電位の準位,仕事関数の準位,第一イオン化エネルギーの準位の相対比較を示す。それぞれの定義が異なるため,順列は一致しないが,特に第一イオン化エネルギーと仕事関数との順列には大きな違いが見て取れる。
この違いの原因は,それぞれの定義における原子の状態の違いによる,すなわち,第一イオン化エネルギーは気体状の原子(原子間相互作用が無い状態)の周りに拘束される軌道電子の持つエネルギーを意味する。一方,仕事関数は金属結晶内の自由電子で構成されるエネルギーバンドの中の電子が持つ最も小さいエネルギーを意味する。従って,金属元素間の準位の違いは,電子を取り巻く環境の違いが反映したものと考えられる。
金属の腐食し易さを評価するには,上述のエネルギーの定義の違いを考慮すると,第一イオン化エネルギーより仕事関数や標準酸化還元電位での比較が適していると考えられる。
一方,標準酸化還元電位と仕事関数では,一部の金属で順位が異なるのが分かる。仕事関数は,真空中に置かれた金属結晶に外部からエネルギーを与え,励起した電子の放出エネルギーを評価しているのに対し,酸化還元電位は液体中に置かれた金属表面の酸化還元反応によりイオン化するためのエネルギーを評価している。
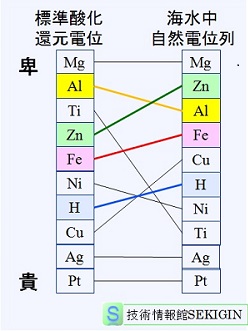
海水中の自然電位列
水の関与する腐食の場合は,「腐食反応と溶存酸素」で示したように,電子を放出した金属イオンは,水分子で囲まれる(水和)。この過程を含む場合,陽イオンの電荷やサイズで水和の影響が異なる。
これらの定義の違いの結果として,上図のように標準酸化還元電位と仕事関数の順列に違いが生じたと考えられる。すなわち,水が関与する腐食の場合は,腐食し易さを標準酸化還元電位で評価するのが望ましいことを示す。
以上をまとめると,乾食(dry corrosion)のし易さは仕事関数で,湿食(wet corrosion)のし易さは標準酸化還元電位で評価するのが望ましいと言える。
実際の水の関与する腐食環境では,水に溶解するイオン相互の影響が無視できない。右図に海水中の自然電位列と標準酸化還元電位の比較を示す。
イオン間の相互作用がない条件で求められる標準酸化還元電位と海水中で計測した自然電位(natural electric potential , spontaneous potential)の順列(腐食電位列ともいう)では,アルミニウム,チタン,亜鉛の順列が大きく入れ替わっている。
すなわち,実用環境で評価する場合には,その環境下における電極電位を計測して評価するのが望ましいことを示す。
ページトップへ
主な用語の概説
乾食(dry corrosion)
液体状の水の作用を受けることなく,腐食性の気体と反応して生じる金属の腐食。【JIS Z0103「防せい防食用語」】
湿食(wet corrosion)
読み「しっしょく」,液体状の水が存在するために起こる金属の腐食。【JIS Z0103「防せい防食用語」】
電極電位(electrode potential)
JIS K 0213 「分析化学用語(電気化学部門)」では
a ) 電極が溶液相などのイオン伝導体相と接しているとき,後者の内部電位に対する前者の内部電位。注記:この値を直接実測することは不可能である。
b ) 注目している電極系を,ある参照電極と組み合わせてガルバニ電池を構成させたとき,注目する電極に取り付けた金属端子の内部電位から,参照電極に取り付けた同種の金属端子の内部電位を差し引いた値。
すなわち,電極電位の絶対値を測定することは不可能で,知ることができるのは,基準とした電極との電位差である。
自然電位(natural electric potential , spontaneous potential)
実用を想定した環境におい計測された電極電位をいう。例えば,海水環境では,海水を電解質溶液として,参照電極と対象金属との開回路(電流が流れない)状態で計測された電位差(開回路電位)から求められる。
腐食電位列(galvanic series)
実用を想定した環境での合金を含む金属の自然電位を実測し,その大きさの順序に配列した列をいう。
金属のイオン化傾向は,純金属に対する理論的に求めた標準酸化還元電位(標準電極電位)を基準にしているが,腐食電位列は実用を想定した環境における実測値を基準にしている。
従って,腐食電位列は,想定する環境が変わると順位も変化するが,合金材料の順位付けが可能であるとともに,異種金属の接触腐食の可能性を推測できるため,工学的に有用な情報を与える。
ページのトップへ