腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
鋼腐食の基礎
鋼の腐食形態(湿食)
湿食(wet corrosion)
金属表面に,液体状態の水が存在するために起こる金属の腐食で,常温付近の比較的低い温度で見られる一般的な金属の腐食形態である。下図にすように,前項で紹介した乾食とはメカニズムが本質的に異なる。乾食では金属表面がアノード(anode)に,酸化物層表面がカソード(cathode)となるのに対し,湿食では,アノードとカソードが鉄表面の異なる場所に生成する。
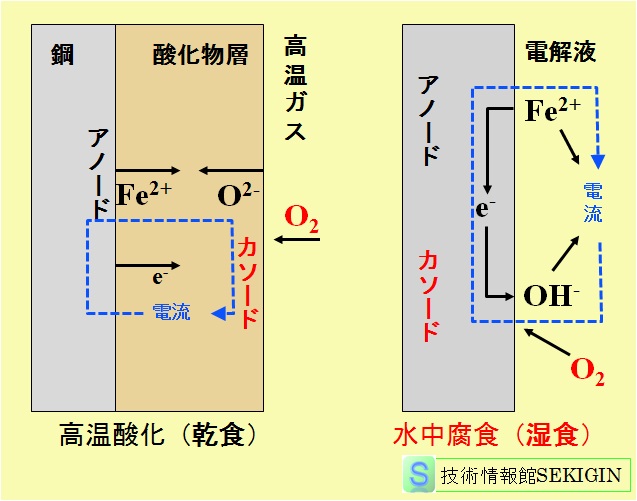
乾食と湿食の腐食メカニズム
湿食のメカニズム
中性の水溶液と接触した鋼の腐食を例に,湿食のメカニズムを説明する。【腐食の開始と継続】で紹介したように,鋼表面のある場所に形成されたアノードで,鉄の酸化反応(Fe→Fe2++2e-)が生じ,電子と鉄イオンが生成する。生成した電子は,別の場所に生じたカソードに向って,鋼内部を移動する。
カソードでは,酸素の還元反応(4e-+O2+2H2O → 4OH-)でアノードで生成した電子量に相当する電子が消費され,同時に水酸イオン(OH-)が生成する。
アノードで生成した鉄イオンとカソードで生成した水酸イオンは,水溶液内部を移動する。これによって,腐食反応の継続が可能な,鋼内部と水溶液内部をつなぐ電気回路が形成される。
鋼表面に,十分な量の中性水溶液(概ね pH4~9.5)が付着した場合に,その腐食速度は,水溶液中の酸素(溶存酸素)の拡散と溶液抵抗(イオンの移動し易さ)の影響を受ける。電解質(支持電解質ともいう)を多く含む水溶液では,イオン移動による電荷移動が容易(溶液抵抗の減少)になり,腐食速度は酸素の拡散速度に依存(酸素拡散律速)するようになる。
酸性の水溶液中(概ね pH4 以下)では,カソード反応が酸素の還元反応から水素イオン(H+ )の還元反応(2e-+2H+ → H2)に移行し,腐食速度は水素イオン濃度,すなわち pH に依存するようになる。
水溶液の pH が塩基性(概ね pH9.5~13)になると,腐食生成物(鉄水酸化物,鉄含水酸化物)が鋼表面に沈着し,緻密な保護性皮膜として作用し腐食速度が減少する。これを不動態化(passivity)と説明されることもある。しかし,pH13以上の強塩基性では,皮膜が鉄酸イオン(FeO22-)として溶解し,腐食速度の増加に至ると考えられている。
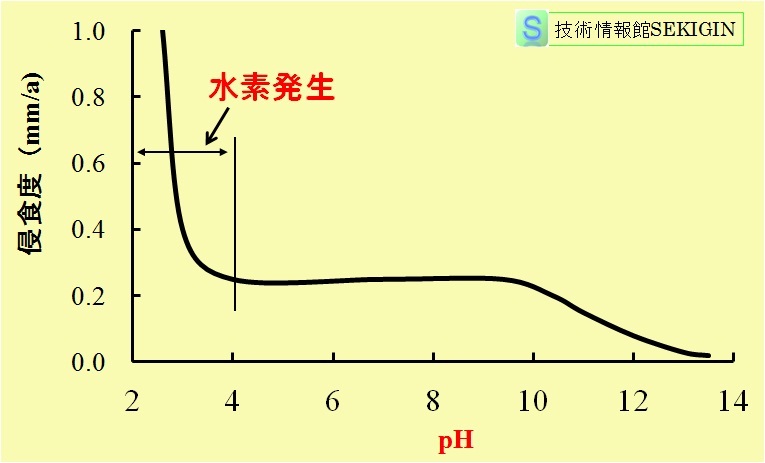
鋼腐食に対する pH の影響
【参考】
酸化・還元(oxidation-reduction)
酸化( oxidation )とは,原子が電子を失うことであり,単体のときより電子密度が低くなった状態である。失った電子の数を正 ( + ) の酸化数とする。
還元( reduction )とは,逆に電子を受け取ることで電子密度が高くなった状態である。受け取った電子の数を負 ( - ) の酸化数とする。
酸化還元反応(oxidation-reduction reaction)
反応物から生成物が生じる化学反応において,物質間で電子の授受のある反応である。酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が並行して進行する。すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それらを別個に扱うことはできない。
電極(electrode)
電気化学では,広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。【JIS K 0213「分析化学用語(電気化学部門)」】
電極を示す名称には,カソード・アノード,正極(+極)・負極(-極),陰極・陽極などの名称が使われている。特に,陰極・陽極の用語は,技術分野で示す意味が異なり,混乱した使用例が見られるので,注意が必要である。
なお,カソード(cathode)は還元反応を生じる電極,アノード(anode)は酸化反応を生じる電極をいう。
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
不動態(passive state)
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。【JIS Z0103「防せい防食用語」】
本来,ひ(卑)である電極電位を示し,不安定であるべき金属があたかも貴である金属のように振る舞う状態。この状態では,電極電位も貴の値を示す場合が多い。【JIS H 0201「アルミニウム表面処理用語」】
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
ページトップへ