腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
淡水環境の腐食
水質の影響(pH)
鋼腐食に対する pH(potential hydrogen ,power of hydrogen)の影響は,古くに研究され,概略で,下図に示す関係が知られている。
すなわち,pH 5~9の中性範囲では,水中での鋼腐食にはカソード(cathode)における酸素の還元反応(reduction reaction)に必要な酸素の沖合から鋼表面への拡散が律速段階(酸素拡散律速;diffusion-controlled process of oxygen)となり,腐食速度は,拡散条件が変わらない限りほぼ一定となる。
カソード反応:4e-+O2+2H2O → 4OH-
pH4~5以下の酸性になると,中性範囲でのカソード反応と異なり,次に示す水素イオンの還元反応(水素ガス発生)に変わり,腐食速度が著しく増大する。水素イオンの拡散は著しく速いので,腐食速度は水素イオン濃度,すなわち pHと鋼表面に付着する水素ガスの離脱の速さに依存する。
カソード反応:2e-+2H+ → H2
pH 9~10以上の塩基性になると,水酸イオンが増加し,鋼表面が不動態化(passivity)する。このため,腐食速度が低下し始める。
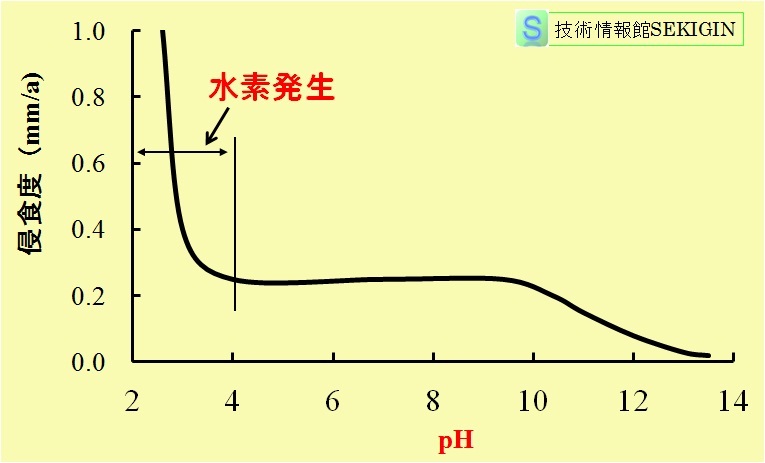
鋼腐食に与えるpHの影響
出典:W. Whitman, R. Russell, V. Altieri, Ind. Eng. Chem., 16,665 (1924)
【蛇足】pHの読みかた
pH:水素イオン濃度指数(potential Hydrogen, power of Hydrogen),読みは1957年に JIS規格で“ピーエイチ”と定められた。現在の JIS規格,及び法令等では“ピーエッチ”と定められている。一方で,1980年代以前の教育現場では,ドイツ語読みの“ペーハー”が主流であった。
このため,pH の読みには「ピーエッチ,ピーエイチ,ペーハー」が混在している。
【参考資料】
1):W. Whitman, R. Russell, V. Altieri, Ind. Eng. Chem., 16,665 (1924)
【参考】
pH (potential hydrogen ,power of hydrogen)
水素イオン濃度指数(potential hydrogen ,power of hydrogen),又は水素イオン指数(hydrogen ion exponent)といわれる。
水素イオン活量(hydrogen ion activity)の逆数の常用対数。 注記 これは概念上の定義で実測できない値である。実用の操作的定義については JIS Z 8802 を参照。【JIS K 0211 分析化学用語(基礎部門)】
この規格に規定した pH 標準液の pH 値を基準とし,ガラス電極 pH 計によって測定される起電力から求められる値。注記 ピーエッチ又はピーエイチと読む。【JIS Z 8802「pH 測定方法」】
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
酸化還元反応(oxidation-reduction reaction)
反応物から生成物が生じる化学反応において,物質間で電子の授受のある反応である。酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が並行して進行する。すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それらを別個に扱うことはできない。
電極(electrode)
電気化学では,広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。【JIS K 0213「分析化学用語(電気化学部門)」】
電極を示す名称には,カソード・アノード,正極(+極)・負極(-極),陰極・陽極などの名称が使われている。特に,陰極・陽極の用語は,技術分野で示す意味が異なり,混乱した使用例が見られるので,注意が必要である。
なお,カソード(cathode)は還元反応を生じる電極,アノード(anode)は酸化反応を生じる電極をいう。
不動態(passive state)
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。【JIS Z0103「防せい防食用語」】
本来,ひ(卑)である電極電位を示し,不安定であるべき金属があたかも貴である金属のように振る舞う状態。この状態では,電極電位も貴の値を示す場合が多い。【JIS H 0201「アルミニウム表面処理用語」】
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
ページトップへ