腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
大気腐食の基礎
大気中を浮遊する海塩粒子の影響
海塩粒子(sea-salt particle)
【大気腐食(実環境):海塩粒子の発生機構】で解説するように,発生当初は海水由来の電解質(electrolyte)で構成される。その後,大気中を浮遊する間に,SOxやNOxなどの大気成分の吸着(adsorption)などで,海水の組成からは変質すると考えられている。
しかしながら,主要な成分に大きな変化はないと考えられるので,海塩粒子に含まれる塩の組成比は,海水中の組成比,すなわち塩化ナトリウム(NaCl) 77.9%,塩化マグネシウム(MgCl2) 9.6%,硫酸マグネシウム(MgSO4) 6.1%,硫酸カルシウム(CaSO4) 4%,塩化カリウム(KCl) 2.1%に近似していると仮定できる。
海塩粒子が付着した表面の濡れについて
一般的な経験として,湿度の高い環境での塩の潮解(deliquescence)(大気中の水蒸気を取り込み水溶液になる)がある。このことは,塩の付着した表面では,【清浄表面への水分子吸着】で解説した条件より低い相対湿度(relative humidity)で厚い水膜を形成する可能性を示唆している。
大気中での塩の潮解現象は,対象とする塩の飽和水蒸気圧(saturated water vapor pressure)に対し,大気の水蒸気圧が高いときに起きる。すなわち,塩の種類と温度が決まれば,潮解現象を起こす相対湿度を的確に予測できる。
海塩粒子に含まれる主な塩について,常温(25℃程度)で潮解し始める相対湿度は,NaCl 約 75%,MgCl2 約 33%%,MgSO4で約 93%,KClは約 84%である。
なお,硫酸カルシウム(いわゆる石膏)は,溶解度約 0.2g/mlと水にほとんど溶解しない。
海塩粒子が付着した固体表面は,相対湿度に応じた水分子の吸着に加えて,塩の潮解による水膜の増加を考慮する必要がある。特に,含有量が多く,低い相対湿度で潮解する塩化マグネシウム(MgCl2)と塩化ナトリウム(NaCl)の寄与が大きいと考えられる。
押川らは,このことに着目し,模擬海塩([Mg2+]/[Na+]=0.11となるNaCl- MgCl2系)を用いて,塩付着量別の相対湿度と水膜厚みの関係を推定している(参考資料1))。
下図には,押川らの模擬海塩付着量(Ws)0.01g・m-2,0.1g・m-2,1.0g・m-2における相対湿度(25℃)と水膜厚みの推定結果を示した。
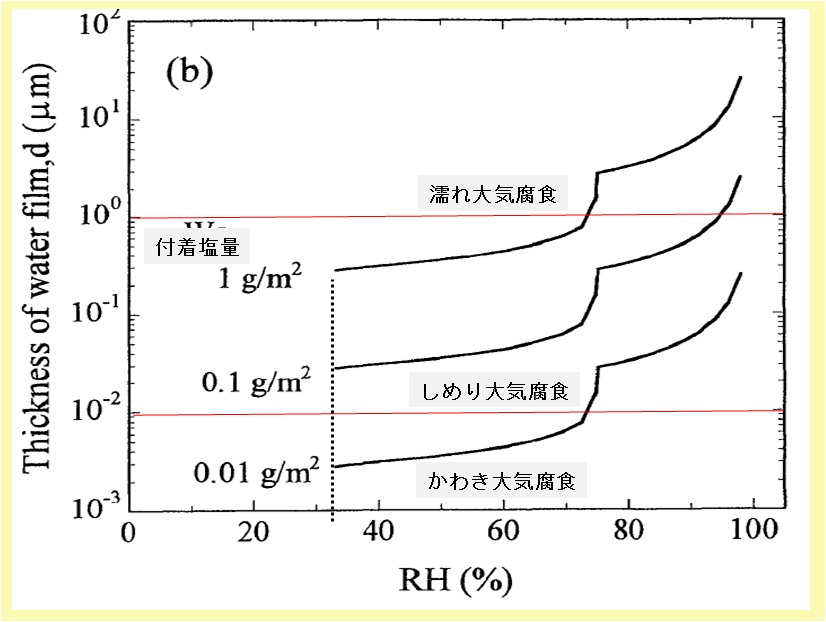
海塩付着鋼表面の相対湿度と水膜厚み
出典:参考資料 1)の図に加筆
押川らの推定結果によると,水膜厚みは,塩化マグネシウム(MgCl2)の潮解が開始する相対湿度 33%で急増する。
その後,塩化ナトリウム(NaCl)の潮解が始まる相対湿度 75%までは,MgCl2水溶液の蒸気圧が大気の水蒸気圧(相対湿度と相関)とバランスするまで希釈されるので,相対湿度の増加と共に水膜厚みが徐々に増加する。
相対湿度 75%に至り,固体として残っていた塩化ナトリウム(NaCl)の潮解が開始するため,再度急激な水膜厚みの増加に至る。
塩の付着量の違いは,形成する水膜厚みの違いに影響している。すなわち,塩の溶解した水溶液の水蒸気圧が大気の水蒸気圧(相対湿度と相関)と平衡になるまで希釈されるので,水膜厚みは概ねで付着塩量と比例関係になる。
一般に,海岸地区で計測される付着塩分量は,構造物構造,風向・風速や立地条件で大きく変化するが,0.1g・m-2以上計測されることも,しばしば経験される。すなわち,押川らの推定結果を参考にすると,海岸地区では相対湿度が低い冬季を除き,【大気腐食の分類】で解説した“湿り(しめり)大気腐食(moist atmospheric corrosion)”の状態に曝される時間が長いことを意味する。
【参考資料】
1)押川渡,篠原正,元田慎一:“強電解質が吸水してできる水膜組成と水膜厚さの推定”,材料と環境,Vol.52, No.6 pp. 293-298(2003)
【参考】
海塩粒子(sea-salt particle)
海岸の波打ち際及び/又は海上で波頭が砕けたときに発生する海水ミストが,風で運ばれて飛来した粒子。海塩粒子の大きさは,約 0.01μm~20μm である。【JIS Z 2381「大気暴露試験方法通則」】
飛来海塩粒子(airborne sea salt particles)
大気中に含まれるエアロゾル粒子の中の海塩粒子を指す。
飛来塩分(flying salinity)
海や塩湖などの自然由来の塩を飛来海塩粒子というが,飛来塩分という場合は,飛来海塩粒子に加え,散布された凍結防止塩,工場などからの人為的な原因で飛来する塩粒子なども含まれる。
潮解(deliquescence)
対象とする物質(固体)の飽和水溶液の水蒸気圧と問題とする環境の水蒸気の分圧(湿度)を比較し,環境の水蒸気の分圧が大きい場合に,物質が環境中の水分子を吸収し,物質を含む水溶液を形成する現象をいう。
固体が残存している場合は,飽和水溶液を形成する。固体がすべて水溶液になった後は,水溶液の水蒸気圧が環境の水蒸気分圧に一致する濃度まで希釈される。この現象を起こす物質には,塩化マグネシウム(MgCl2), 水酸化ナトリウム(NaOH),塩化カルシウム(CaCl2) ,クエン酸(C6H8O7)などがある。
飽和水蒸気圧(saturated water vapor pressure , saturated steam pressure)
気象学において,水蒸気が気液平衡にある場合の蒸気圧をいい,一般的には平衡蒸気圧という。
なお,地表付近(一気圧),温度 T(℃)の飽和水蒸気圧は,Es(T) ≒ 6.1078・exp{ 17.27・T/(T+237.3)} で近似できる。
平衡蒸気圧(equilibrium vapor pressure)
液相,又は固相と相平衡になる気相の圧力で,温度に依存して決まる物質特有の物性値である。
ちなみに, 液相にあるときの蒸気圧が外圧に等しくなる温度を沸点(boiling point),固相の蒸気圧が外圧に等しくなる温度を昇華点(sublimation point)という。
海塩粒子(sea-salt particle)
【大気腐食(実環境):海塩粒子の発生機構】で解説するように,発生当初は海水由来の電解質(electrolyte)で構成される。その後,大気中を浮遊する間に,SOxやNOxなどの大気成分の吸着(adsorption)などで,海水の組成からは変質すると考えられている。
しかしながら,主要な成分に大きな変化はないと考えられるので,海塩粒子に含まれる塩の組成比は,海水中の組成比,すなわち塩化ナトリウム(NaCl) 77.9%,塩化マグネシウム(MgCl2) 9.6%,硫酸マグネシウム(MgSO4) 6.1%,硫酸カルシウム(CaSO4) 4%,塩化カリウム(KCl) 2.1%に近似していると仮定できる。
海塩粒子が付着した表面の濡れについて
一般的な経験として,湿度の高い環境での塩の潮解(deliquescence)(大気中の水蒸気を取り込み水溶液になる)がある。このことは,塩の付着した表面では,【清浄表面への水分子吸着】で解説した条件より低い相対湿度(relative humidity)で厚い水膜を形成する可能性を示唆している。大気中での塩の潮解現象は,対象とする塩の飽和水蒸気圧(saturated water vapor pressure)に対し,大気の水蒸気圧が高いときに起きる。すなわち,塩の種類と温度が決まれば,潮解現象を起こす相対湿度を的確に予測できる。
海塩粒子に含まれる主な塩について,常温(25℃程度)で潮解し始める相対湿度は,NaCl 約 75%,MgCl2 約 33%%,MgSO4で約 93%,KClは約 84%である。
なお,硫酸カルシウム(いわゆる石膏)は,溶解度約 0.2g/mlと水にほとんど溶解しない。
海塩粒子が付着した固体表面は,相対湿度に応じた水分子の吸着に加えて,塩の潮解による水膜の増加を考慮する必要がある。特に,含有量が多く,低い相対湿度で潮解する塩化マグネシウム(MgCl2)と塩化ナトリウム(NaCl)の寄与が大きいと考えられる。
押川らは,このことに着目し,模擬海塩([Mg2+]/[Na+]=0.11となるNaCl- MgCl2系)を用いて,塩付着量別の相対湿度と水膜厚みの関係を推定している(参考資料1))。
下図には,押川らの模擬海塩付着量(Ws)0.01g・m-2,0.1g・m-2,1.0g・m-2における相対湿度(25℃)と水膜厚みの推定結果を示した。

海塩付着鋼表面の相対湿度と水膜厚み
出典:参考資料 1)の図に加筆
その後,塩化ナトリウム(NaCl)の潮解が始まる相対湿度 75%までは,MgCl2水溶液の蒸気圧が大気の水蒸気圧(相対湿度と相関)とバランスするまで希釈されるので,相対湿度の増加と共に水膜厚みが徐々に増加する。
相対湿度 75%に至り,固体として残っていた塩化ナトリウム(NaCl)の潮解が開始するため,再度急激な水膜厚みの増加に至る。
塩の付着量の違いは,形成する水膜厚みの違いに影響している。すなわち,塩の溶解した水溶液の水蒸気圧が大気の水蒸気圧(相対湿度と相関)と平衡になるまで希釈されるので,水膜厚みは概ねで付着塩量と比例関係になる。
一般に,海岸地区で計測される付着塩分量は,構造物構造,風向・風速や立地条件で大きく変化するが,0.1g・m-2以上計測されることも,しばしば経験される。すなわち,押川らの推定結果を参考にすると,海岸地区では相対湿度が低い冬季を除き,【大気腐食の分類】で解説した“湿り(しめり)大気腐食(moist atmospheric corrosion)”の状態に曝される時間が長いことを意味する。
【参考資料】
1)押川渡,篠原正,元田慎一:“強電解質が吸水してできる水膜組成と水膜厚さの推定”,材料と環境,Vol.52, No.6 pp. 293-298(2003)
【参考】
海塩粒子(sea-salt particle)
海岸の波打ち際及び/又は海上で波頭が砕けたときに発生する海水ミストが,風で運ばれて飛来した粒子。海塩粒子の大きさは,約 0.01μm~20μm である。【JIS Z 2381「大気暴露試験方法通則」】
飛来海塩粒子(airborne sea salt particles)
大気中に含まれるエアロゾル粒子の中の海塩粒子を指す。
飛来塩分(flying salinity)
海や塩湖などの自然由来の塩を飛来海塩粒子というが,飛来塩分という場合は,飛来海塩粒子に加え,散布された凍結防止塩,工場などからの人為的な原因で飛来する塩粒子なども含まれる。
潮解(deliquescence)
対象とする物質(固体)の飽和水溶液の水蒸気圧と問題とする環境の水蒸気の分圧(湿度)を比較し,環境の水蒸気の分圧が大きい場合に,物質が環境中の水分子を吸収し,物質を含む水溶液を形成する現象をいう。
固体が残存している場合は,飽和水溶液を形成する。固体がすべて水溶液になった後は,水溶液の水蒸気圧が環境の水蒸気分圧に一致する濃度まで希釈される。この現象を起こす物質には,塩化マグネシウム(MgCl2), 水酸化ナトリウム(NaOH),塩化カルシウム(CaCl2) ,クエン酸(C6H8O7)などがある。
飽和水蒸気圧(saturated water vapor pressure , saturated steam pressure)
気象学において,水蒸気が気液平衡にある場合の蒸気圧をいい,一般的には平衡蒸気圧という。
なお,地表付近(一気圧),温度 T(℃)の飽和水蒸気圧は,Es(T) ≒ 6.1078・exp{ 17.27・T/(T+237.3)} で近似できる。
平衡蒸気圧(equilibrium vapor pressure)
液相,又は固相と相平衡になる気相の圧力で,温度に依存して決まる物質特有の物性値である。
ちなみに, 液相にあるときの蒸気圧が外圧に等しくなる温度を沸点(boiling point),固相の蒸気圧が外圧に等しくなる温度を昇華点(sublimation point)という。
ページトップへ