腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食と化学反応に関連し, 【腐食と電気化学】, 【主な用語】 を紹介する。
腐食は化学反応
腐食と電気化学
湿食(wet corrosion)では,金属表面の特定の場所(アノード)で,金属原子(M)が酸化反応により金属イオン( M2+ など)となり表面から離脱する。
同時に還元反応が酸化反応の場所とは異なる場所(カソード)で生じる。金属表面に付着する水溶液が中性で酸素を含む(溶存酸素という)場合には,水溶液中の酸素が還元され,水酸化物イオン( OH‐)を生成する。この化学反応を式にまとめると,
2M+O2+2H2O → 2M2++4OH‐
となる。
腐食反応は,【電荷保存則と腐食】で紹介したように,均質な溶液中の反応ではなく,固体の金属表面で起きる。すなわち,水中を拡散してきた酸素分子が金属表面に衝突(吸着)することで,電子を受け取る還元反応が起きる。
下図に水滴の付着した鋼表面での腐食の模式図を示す。模式図は,大気環境で一般的に見られる均一腐食(uniform corrosion)とは腐食機構が異なり,水滴内部の酸素濃度差による濃淡電池腐食(concentration cell corrosion)や通気差腐食(differential aeration corrosion)に近いが,アノードとカソードの関係が分かり易いのでここに示した。
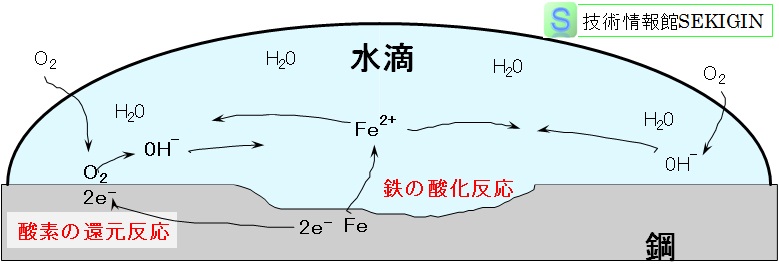
金属表面の水滴中での腐食反応模式図
金属原子のイオン化と酸素の還元が異なる個所で生じる理由は,電子( e-)が金属体の内部を自由に動けることにある。これを化学式で表わすと,
金属の酸化される場所: 2M → 2M2++4e-
酸素の還元される場所: 4e-+O2+2H2O → 4OH-
となる。
化学反応での電子の授受を扱う学問領域を電気化学(electrochemistry)という。金属のイオン化と酸素の還元に関するそれぞれの化学式は,下図に示すダニエル電池(Daniel cell)の+極(還元反応)と-極(酸化反応)を導線で結んだ際のそれぞれの極で起きる反応(半電池反応)と同様に扱える。
すなわち,腐食反応を電気化学で取り扱うのが合理的であることを示す。
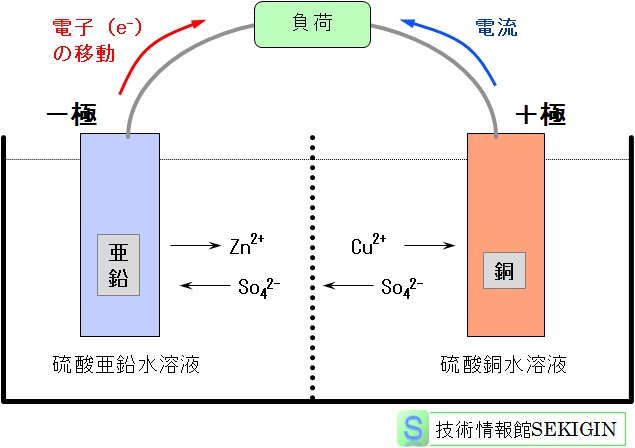
ダニエル電池(模式図)
ページトップへ
主な用語の概説
電極について
電気化学で用いる用語の中で,一般に用いる意味とは異なる意味で用いるものがあるので,注意が必要である。例えば,一対の電極について,一般的には電位の高い方を陽極や正極(+極),低い方を陰極や負極(-極)というのに対し,電気化学では,電位の高低ではなく,電子の授受を扱うため,外部回路に電子が流れ出す電極をアノード,外部回路から電子が流れ込む電極をカソードと定義されている。
従って,図のダニエル電池では,電池として-極(陰極)である亜鉛が電気化学で扱う場合はアノード(陽極)になり,電池として+極(陽極)である銅がカソード(陰極)となる。
一方,電気分解装置では,電位の高い陽極をアノード,陰極をカソードとするなど,混乱しやすいので注意が必要である。
アノード(anode)
電流が電極から電解質に向かって流れ,酸化反応が行われる電極。陽極ともいう。【JIS Z0103「防せい防食用語」】
カソード(cathode)
電流が電解質から電極に向かって流れ,還元反応が行われる電極。陰極ともいう。【JIS Z0103「防せい防食用語」】
電極反応(electrode reaction)
電極と電解質溶液,溶融塩などのイオン伝導体との間で起こる少なくとも一つの電荷移動過程,及びそれに伴って電極近傍で起こる物質移動,化学反応などの全ての過程。狭義には,電荷移動過程だけをいう。【JIS K 0213 「分析化学用語(電気化学部門)」】
電極反応には,電極と電解質で構成される系,電極と電解質溶液で構成される 2 つの系があり。問題(研究対象)とするのは,電解質,又は電解質溶液全体で均一に進む現象ではなく,電極との界面で生じる酸化還元反応,すなわち不均一系の反応である。
半電池反応(half‐cell reaction)
化学電池での電極反応をいい,酸化還元反応の酸化と還元の反応を分けて記述する半反応式とは定義が異なる。
酸化還元反応(oxidation-reduction reaction)
反応物から生成物が生じる化学反応において,物質間で電子の授受のある反応である。酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が同時に進行する。すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それらを別個に扱うことはできない。
半反応式(half reaction)
酸化還元反応は,酸化と還元を分けて記述すると理解しやすい。この一方のみに注目した記述方式を半反応式と呼ぶ。
ページのトップへ