腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
鋼腐食の基礎
鋼の腐食形態(乾食)
乾食(dry corrosion)
金属が酸素,水蒸気(気体状態),炭酸ガスなどの反応性気体との接触で直接反応し,金属表面に反応生成物(酸化物)の固体被膜を生成しながら金属が消耗する現象である。低温では反応速度が非常に遅く,実用上で問題となることが少ないが,高温環境で速やかに進み,実用上の不具合を生じるため,乾食は,高温腐食(high temperature corrosion)や高温酸化ともいわれる。
次項で紹介する液体状の水が関わる湿食(wet corrosion)と乾食とでは,メカニズムが根本的に異なる。この違いが分かるように乾食と湿食の模式図を比較に示しながら,乾食について紹介する。
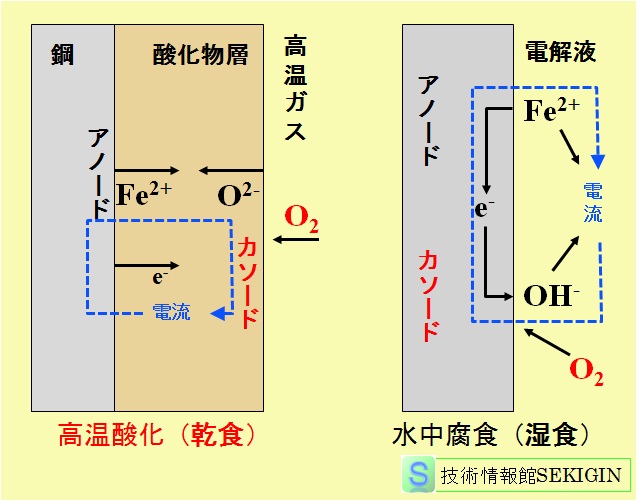
乾食と湿食の腐食メカニズム
乾食のメカニズム
例えば,鋼が酸素を含む高温の雰囲気に曝された場合に,金属表面全体がアノード(anode)となり,鉄の酸化反応(Fe→Fe2++2e-)が進み,電子を放出しつつ鉄イオンが生成する。放出された電子と鉄イオンは,表面に生成した酸化物の層(格子欠陥を持ち,半導体的性質を有する。)の中を拡散(diffusion)し,酸化物層の表面に形成したカソード(cathode)に移動する。
カソードでは,高温の酸素が電子を受け取る還元反応(4e-+O2→2O2-)で酸素イオン(O2-)が生成する。酸素イオンは,金属表面に向って酸化物層の内部を移動する。これにより,金属表面と酸化物層表面との間に電気回路が形成される。
酸化反応,還元反応とも直ちに進行するので,腐食速度に影響するのは,イオンサイズの大きい酸素イオンである。すなわち,乾食の速度は,酸素イオンの酸化物層(固体)内でのフィックの法則に従う拡散速度に依存する。
厳密には,酸化物皮膜が緻密な場合には固体内の拡散として扱えるが,皮膜の体積収縮などで微細な亀裂が発生すると物質の移動が容易になり,より早い速度で腐食することになる。
生成した酸化物層の内部構成は,鉄素地に近い方からウスタイト(FeO:570℃以上で生成),マグネタイト(Fe3O4),ヘマタイト(Fe2O3)と酸素濃度の異なる組成の酸化鉄(iron oxide)の層が形成されると考えられている。
【参考】
酸化・還元(oxidation-reduction)
酸化( oxidation )とは,原子が電子を失うことであり,単体のときより電子密度が低くなった状態である。失った電子の数を正 ( + ) の酸化数とする。
還元( reduction )とは,逆に電子を受け取ることで電子密度が高くなった状態である。受け取った電子の数を負 ( - ) の酸化数とする。
酸化還元反応(oxidation-reduction reaction)
反応物から生成物が生じる化学反応において,物質間で電子の授受のある反応である。酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が並行して進行する。すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それらを別個に扱うことはできない。
電極(electrode)
電気化学では,広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。【JIS K 0213「分析化学用語(電気化学部門)」】
電極を示す名称には,カソード・アノード,正極(+極)・負極(-極),陰極・陽極などの名称が使われている。特に,陰極・陽極の用語は,技術分野で示す意味が異なり,混乱した使用例が見られるので,注意が必要である。
なお,カソード(cathode)は還元反応を生じる電極,アノード(anode)は酸化反応を生じる電極をいう。
フィックの法則(Fick's laws of diffusion)
気体,液体のみならず固体(金属)にも適用できる物質の拡散に関する基本法則である。フィックの法則には第 1法則と第 2法則がある。
フィックの第 1法則:“拡散束(流束;flax)は,濃度勾配に比例する”と表現される法則で,定常状態拡散(濃度が時間で変わらない)で適用される。
拡散係数を D ,位置 x での濃度 c とした時,拡散束 J は,
J = − D grad c あるいは J = − D ( dc /dx )
で与えられる。
フィックの第 2法則;実際の拡散で見られる濃度が時間に関して変わる非定常状態拡散に適用される。拡散係数 D が定数のとき,濃度 c の時間変化は,
∂c /∂t = − div J = D∇2 c あるいは∂c /∂t = D (∂2 c /∂x2 )
で与えられる。
酸化鉄(iron oxide)
酸化鉄には,鉄の酸化数と結晶構造により複数存在する。
安定,及び準安定の化合物には,二価鉄のFeO (酸化鉄(Ⅱ),ウスタイト,Wüstite ),二価鉄と酸化鉄の Fe3O4 (酸化鉄(II,III),四酸化三鉄,四三酸化鉄,マグネタイト,magnetite ,磁鉄鉱)がある。
三価鉄の酸化物には,結晶構造の違う α- Fe2O3 (α酸化鉄(Ⅲ),ヘマタイト,hematite ,赤鉄鉱),β-Fe2O3 (β酸化鉄(Ⅲ)),γ-Fe2O3 (γ酸化鉄(Ⅲ),マグヘマイト,maghemite ,磁赤鉄鉱),ε-Fe2O3 (ε酸化鉄(Ⅲ))などがある。
ページトップへ