腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
淡水環境の腐食
溶存酸素の拡散
【酸素の拡散について】
前項の【溶存酸素濃度の影響】で紹介したように,水で濡れた鋼の腐食速度(corrosion velocity)は,鋼表面に接触する溶存酸素(dissolved oxygen)の影響を強く受ける。ここでは,鋼表面近傍における溶存酸素の挙動を解説する。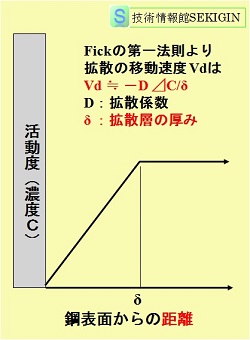
溶存酸素の拡散
従って,鋼表面から十分に離れた沖合の溶存酸素濃度を C(mol・m-3)とすると,沖合から鋼表面に向って溶存酸素の濃度勾配(concentration gradient)が発生することになる。この濃度勾配は,一般的に,右図に示すように,Fickの第一法則に従うと考えられている。
Fickの第一法則によると,鋼表面からある距離δ(拡散層の厚み,m)離れたところの溶存酸素濃度 Cのとき,拡散により鋼表面に供給される酸素の流束 J (フラックス: flux,単位時間に単位面積当たりの通過量)は次式で表わされる.
J= DC/δ
ここに,D(m2・s-1)は酸素の拡散係数(diffusion coefficient)
式から,鋼表面に供給される溶存酸素の量は,水中(沖合)の溶存酸素濃度 Cに比例し拡散層の,厚みδ(静止した水で概ね 500μm)に反比例することが分かる。
【腐食量について】
ここで,常温(25℃)でほぼ静止している淡水(空気飽和)中における最大の腐食度を求めてみる。空気で飽和した常温淡水の溶存酸素濃度を 8ppm(≒8/32mol・m-3),酸素の拡散係数 D= 2×10-9m2・s-1),ほぼ静止する水の拡散層の厚みδ= 5×10-4mとする。
この条件で,鋼表面の酸素が直ちに還元される場合の酸素の流束 J は,
J= D(2×10-9m2・s-1)×(8/32mol・m-3)÷(5×10-4m)=1×10-6(mol・m-2・s-1)
となる。これを,1年間(平均太陽年 1a≒ 31.557×106秒)で消費される酸素量に換算すると,
1×10-6(mol・m-2・s-1)×31.557×106= 31.557(mol・m-2・a-1)
となる。
中性水溶液中の鋼腐食では,酸素 1mol消費で鉄 2molが溶解する。従って,1年間の鉄(原子量 55.845g・mol-1,密度 7.874 ton・m-3)の最大腐食度は,
63.072(mol・m-2・a-1)×55.845(g・mol-1)=3.522(kg・m-2・a-1)
と計算される。これを厚み減少量(侵食度)に換算すると,
3.522(kg・m-2・a-1)÷7.874×103 (kg・m-3)=4.47×10-4(m・a-1)
となる。すなわち,1年間に 447μm の鋼板厚み減少と計算される。
実際には,溶存酸素の一部は水酸化鉄(Ⅱ)の酸化に消費されること,鋼表面に付着した腐食生成物(結晶性,非晶質性の含水水酸化鉄,その後の酸化還元で生成するマグネタイトなど)による酸素の拡散障害などにより,測定される腐食度や侵食度は計算値より小さい。
一般的には,表面を磨いた直後の活性な鋼板を室温の静止した軟水に浸漬した直後には,計算値に近い早さで腐食するが,数日内に侵食度が 50~100μm・a-1程度に低下し,その後は,曝された環境に応じ,ほぼ一定の量で腐食する現象が観察される。
このことは,初期に鋼表面に付着した腐食生成物(鋼表面の極近傍)により,溶存酸素拡散の機構が変わったことを示唆する。
【参考資料】
H. Uhlig, D. Triadis, M. Stern: J. Electrochem. Soc., 102,59 (1955)
【参考】
フィックの法則(Fick's laws of diffusion)
気体,液体のみならず固体(金属)にも適用できる物質の拡散に関する基本法則である。フィックの法則には第 1法則と第 2法則がある。
フィックの第 1法則
“拡散束(流束;flax)は,濃度勾配に比例する”と表現される法則で,定常状態拡散(濃度が時間で変わらない)で適用される。拡散係数を D ,位置 x での濃度 c とした時,拡散束 J は,J = − D grad c あるいは J = − D ( dc /dx ) で与えられる。
フィックの第 2法則
実際の拡散で見られる濃度が時間に関して変わる非定常状態拡散に適用される。拡散係数 D が定数のとき,濃度 c の時間変化は,∂c /∂t = − div J = D∇2 cあるいは∂c /∂t = D (∂2 c /∂x2 ) で与えられる。
拡散係数(diffusion coefficient)
物質の拡散に関し,拡散量と濃度勾配の関係を与えるフィックの法則で定義される比例項で,拡散する分子の平均速度で,物質の拡散の早さの指標と考えられる。
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
ページトップへ