腐食概論:鋼の腐食
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(鋼の腐食)” ⇒
淡水環境の腐食
溶存酸素濃度の影響
淡水中の溶存酸素(dissolved oxygen)の濃度を変えた時,鋼の腐食速度(corrosion velocity)に与えるの影響の検討例を下図に示す。この図は,中性で塩化物イオンを多く含まない淡水を緩やかに攪拌し,この中に鋼板(1950年代のSS材)を入れ,腐食速度(厳密には腐食度;corrosion rate)を計測した例である。
穏やかに攪拌しているので,静止水とは異なるが,「流速の影響」の項で解説するように,撹拌の影響が非常に小さい条件での試験と考えられる。
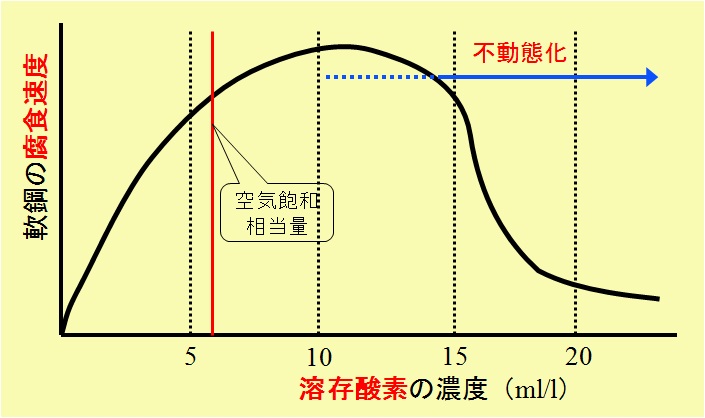
淡水中における鋼の腐食速度と溶存酸素濃度の関係
参考:H. Uhlig, D. Triadis, M. Stern, J. Electrochem. Soc., 102, 59(1955)
不活性ガスを送り込み,溶液中に含まれる気体成分を置換(脱気)し,溶存酸素を含まない条件である。この条件では,中性水溶液中における酸化還元反応(oxidation-reduction reaction)のカソード反応(酸素の還元反応)が進まないため,計測できるほどの腐食は観察されない。
溶存酸素の濃度増加と共に,鋼表面のカソード部で還元できる酸素量が増加し,腐食速度が増加する。
溶存酸素濃度が,大気と接触する水の飽和濃度(図中の赤線,5.6mℓ/ℓ)を超え,10mℓ/ℓ*程度までは,酸素濃度増加に伴い腐食速度も増加し続ける。しかし,それ以上の高酸素濃度では,腐食速度の減少が始まる。
*:酸素の分子量 32,20℃の気体 1モルの体積は 22.4リットルなので,10mℓは 32(g)×10-2(ℓ)/22.4(ℓ)=14.3mg となる。従って,溶存酸素濃度 10mℓ/ℓは,ppm 表示で 14.3ppm となる。ちなみに,空気飽和状態の溶存酸素濃度(飽和溶存酸素量;oxygen saturation)は,常温で概ね 8ppm(≒5.6mℓ/ℓ)である。
【腐食速度について】
実際の鋼などの金属腐食の速さは,【酸素拡散律速とは】で解説したように,カソード部における化学反応ではなく,水中の溶存酸素が拡散し,鋼表面に達する過程が律速(酸素拡散律速;diffusion-controlled process of oxygen)となり決まる。溶存酸素の拡散は,Fickの法則(Fick's laws of diffusion)に従うと仮定すると,鋼表面に到達する溶存酸素量は,沖合の酸素濃度と一次の比例関係にある。
また,鋼表面に到達した溶存酸素が直ちにカソード反応(cathodic reaction)で消費されると仮定すると,腐食速度は,沖合の溶存酸素濃度と拡散層の厚みに比例することになる。
【図に示された腐食速度の挙動について】
溶存酸素濃度が約 3mℓ/ℓまでは,鋼の表面に供給される溶存酸素が沖合の溶存酸素濃度の増加に比例して腐食速度が増加する。
更に溶存酸素濃度が増加すると,腐食速度の増加に伴い鋼表面近傍での二価鉄イオン量も増加する。これにより,鋼表面近傍において,二価鉄イオンの加水分解,酸化反応による溶存酸素が消費される。また,鋼表面への腐食生成物の付着などの酸素拡散障害があり,溶存酸素濃度 3~10mℓ/ℓでは,溶存酸素濃度の増加に比較して,腐食速度の増加の伸びが小さくなると考えられる。
さらに,溶存酸素濃度が高くなると,鋼表面に緻密な酸化皮膜が形成される不動態化(passivity)が見られるようになり,約 12mℓ/ℓを超えて腐食速度の急激な低下に至る。なお,鋼の不動態化の難易は水質(塩化物イオン量など)に依存する。
【参考資料】
H. Uhlig, D. Triadis, M. Stern, J. Electrochem. Soc., 102, 59(1955)
【参考】
酸化還元反応(oxidation-reduction reaction)
反応物から生成物が生じる化学反応において,物質間で電子の授受のある反応である。酸化還元反応では,ある物質の酸化過程と他の物質の還元過程が並行して進行する。すなわち,一般にいうところの「酸化反応」と「還元反応」は,対象物質を見る立場で,現象の説明を容易にするために用いる便宜的な用語であり,それらを別個に扱うことはできない。
アノード反応(anodic reaction):電極反応において,アノードで起きる酸化反応。
カソード反応(cathodic reaction):電極反応において,カソードで起きる還元反応。
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
フィックの法則(Fick's laws of diffusion)
気体,液体のみならず固体(金属)にも適用できる物質の拡散に関する基本法則である。フィックの法則には第 1法則と第 2法則がある。
フィックの第 1法則
“拡散束(流束;flax)は,濃度勾配に比例する”と表現される法則で,定常状態拡散(濃度が時間で変わらない)で適用される。拡散係数を D ,位置 x での濃度 c とした時,拡散束 J は,J = − D grad c あるいは J = − D ( dc /dx ) で与えられる。
フィックの第 2法則
実際の拡散で見られる濃度が時間に関して変わる非定常状態拡散に適用される。拡散係数 D が定数のとき,濃度 c の時間変化は,∂c /∂t = − div J = D∇2 cあるいは∂c /∂t = D (∂2 c /∂x2 ) で与えられる。
腐食速度(corrosion velocity)
腐食速度(corrosion velocity)とは,金属腐食に関わる化学反応の反応速度(reaction velocity)をいう。反応速度とは,化学反応において,反応物(又は生成物)の量の時間変化率を表す物理量と定義される。
一般的に,金属の腐食過程では,腐食速度は時々刻々変化するので,暴露試験など比較的長い時間に計測した腐食反応物や生成物の変化量を示す場合は,腐食速度(corrosion velocity)ではなく,腐食度(corrosion rate)や侵食度(penetration rate)を用いるのが良い。
日本語の腐食速度という用語は,反応速度と同様に,厳密に使い分けられているわけではない。例えば,JIS G 0202「鉄鋼用語(試験)」では,腐食速度(corrosion rate)として“腐食減量を単位時間,単位面積当たりで表わした値”,侵食速度(penetration rate)として“腐食減量から計算される単位時間当たりの平均腐食深さ。”と定義している。
なお,同 JIS では,腐食減量(mass loss , corrosion loss)を“腐食試験後,表面に付着した腐食生成物を取り除いた試験片の質量減,又は単位表面積当たりの質量減。”と定義している。
腐食度(corrosion rate)
ある期間に生じた単位面積当たりの腐食量をその期間で除して求められる値。【JIS Z0103「防せい防食用語」】
この値は,暴露期間中に時々刻々変化する腐食速度(金属の腐食反応速度)とは異なる。また,同じ条件の試験であっても,暴露期間が異なると腐食度も異なる。単位は,単位面積当たり,1年(平均太陽年)当たりのグラム数(g・m-2・a-1)で表わす。
大気暴露試験で得られる腐食度は,暴露開始時期の違い(例えば春開始と秋開始など)の影響も受ける。このため,腐食度で腐食性評価を行う場合には,暴露環境条件に加えて,暴露開始時期,暴露期間(暴露1年目や暴露X-Y年など)などの情報を併記するのが望ましい。
不動態(passive state)
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。【JIS Z0103「防せい防食用語」】
本来,ひ(卑)である電極電位を示し,不安定であるべき金属があたかも貴である金属のように振る舞う状態。この状態では,電極電位も貴の値を示す場合が多い。【JIS H 0201「アルミニウム表面処理用語」】
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
不動態化(passivity)で生じた金属表面に腐食作用に抵抗する酸化被膜を不動態被膜(passive film)という。
ページトップへ