第一部:化学と物質構造・共有結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,原子・原子間の多重結合について,【多重結合の特徴】, 【電子の共鳴(非局在のΠ結合)】 に項目を分けて紹介する。
多重結合の特徴
多重結合の特徴について,炭素数 2個と水素で構成される炭化水素(エタン,エチレン,アセチレン)を例に紹介する。
エタン( C2H6 )は,sp3 混成軌道の炭素原子による単結合の分子,
エチレン(エテン: C2H4 )は,sp2 混成軌道の炭素原子による二重結合の分子,
アセチレン(エチン: C2H2 )は,sp 混成軌道の炭素原子による三重結合の分子である。
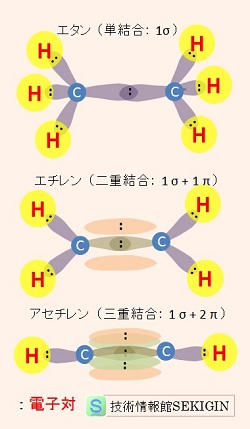
炭化水素の例
炭素・炭素間の結合距離
エタン( 153pm ),エチレン( 134pm ),アセチレン( 121pm )と単結合より二重結合,二重結合より三重結合の方が短い。
炭素・炭素間の結合エネルギー( binding energy )
エタン( 331 kJ / mol ),エチレン( 591 kJ / mol ),アセチレン( 827 kJ / mol )と単結合より二重結合,二重結合より三重結合の方が大きいが,エチレンとエタンのエネルギー差は 260 kJ / mol ,アセチレンとエチレンのエネルギー差は 236 kJ / mol と,単結合であるエタンの結合エネルギーより小さい。
これは,パイ結合の結合エネルギーは,シグマ結合の結合エネルギーより小さいことを意味する。
一般的に,多重結合を持つ多くの化合物は,単結合の化合物より反応性が大きい。これは,パイ結合のエネルギーがシグマ結合より低いうえに,攻撃試薬がシグマ結合の電子よりパイ結合の電子に近づきやすいためと考えられている。
【参考】
結合エネルギー( binding energy )
結合エネルギーとは,分子や結晶を構成する原子がばらばらに存在する状態との間でのポテンシャルエネルギーの差をいう。
結合エネルギーは,分子の持つ全結合を切断するためのエネルギーの総和となる。なお,分子中の結合を一つ一つ切断するのためのエネルギーは,結合解離エネルギーという。
ページのトップへ
電子の共鳴(非局在のパイ結合)
酸素分子( O2 )は,原子番号 8の酸素原子(電子配置: 1s2 2s2 2p4 ) 2 個が二重結合で結ばれた分子( O = O : sp 混成軌道)である。それでは,酸素原子 3 個が結合したオゾン( O3 )はどのような構造になっているのか。
酸素分子の最外殻電子は,すでに 8個で希ガス構造となっている。一方,酸素原子の最外殻電子は 6個で,2個の電子を受け取ることで希ガス構造になれる。
そこで,【その他の結合】で紹介する配位結合( coordinate bond )のような状況を考えてみる。すなわち,酸素原子が水素分子の共有電子対を受け取り結合する状態である。
この状況の分子構造式は,酸素原子間の二重結合とイオンを用いて「 O=O+-O- 」と書くこともできるが,両端の酸素原子は等価なため,この状態では安定できない。従って,オゾンは「 O=O+-O- 」と「 O--+O=O 」の両方の状態の中間的な状態にあると考えられる。
この状態を共鳴しているといい,この時の構造式は共鳴混成体という。この状態では,パイ結合の電子が 2つの原子間に局在しているのではなく,2 つ以上の原子と相互作用していると考えられる。構造式では,実線と点線の二重線で表現する。
この相互作用は非局在化と呼ばれ,2つの原子間でパイ結合を形成するために用いられる軌道が隣の原子の軌道と重なり合っていると考えられる。
このような非局在のパイ結合は,二酸化硫黄( SO2 ),三酸化硫黄( SO3 ),酸化二窒素( N2O ),ベンゼン( C6H6 )などの化合物で見られる。
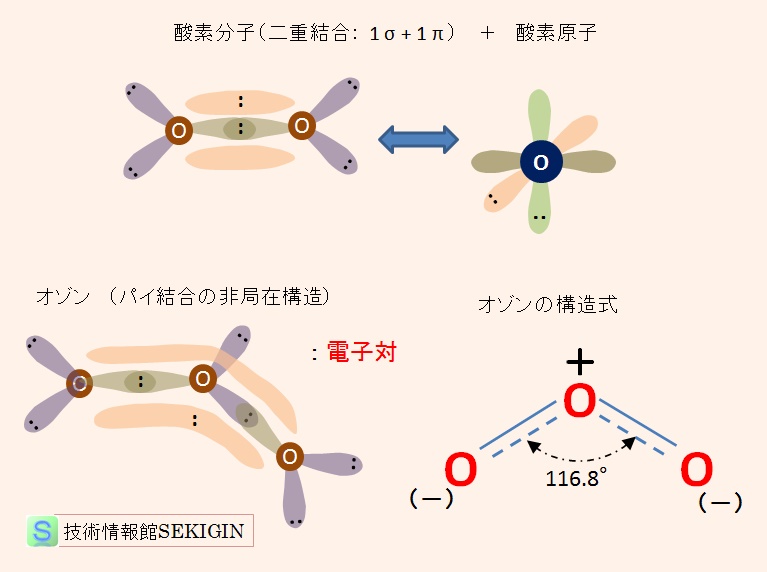
酸素分子とオゾン分子
【参考】
配位結合( coordinate bond )
結合する二つの原子において,結合に関わる電子対が一方の原子のみから提供される化学結合である。
配位結合は,ルイス酸とルイス塩基との結合でもある。電子対を受け取る物質はルイス酸,電子対を与える物質はルイス塩基となる。
ページの先頭へ