第二部:物質の状態と変化 液体への溶解(実例)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,溶質として身近な無機塩の水(溶媒)への溶解について,【溶媒としての水の特徴】, 【溶媒の溶解パラメータ比較】, 【無機塩の水への溶解について】, 【溶解度積】 に項目を分けて紹介する。
溶媒としての水の特徴
水とは
化学式( H2O ,HOH )で表される水( water ;IUPAC系統名 オキシダン oxidane )は,水素と酸素の共有結合で得られる化合物である。この化合物は,一般名称では,温度や状態により,気体状態の場合に水蒸気,液体状態では,体温より高い温度で湯や湯気,体温より低い温度では水,固体状態の場合には氷と呼ばれる。
液体としての水の特徴
水の特異性で紹介するように,水は他の物質に比較して次のような特異性を示す。
● 同等の分子量の他の液体に比較して融点・沸点が高い,単位質量当たりの比熱容量(比熱)・蒸発熱(気化熱)が主要な物質中で最大級の高い値をとる。
● 金属を除く物質の中では,表面張力が大きい。
● 密度と温度の関係は,多くの物質は温度低下で単調に増加するが,水はある温度(約 4℃)で最大値を持つ挙動を示す。
● 一部の物質(チタン酸バリウム,ロッシェル塩,シアン化水素など少数)を除き,一般的な物質の中で高い誘電率を持つ。 水は反磁性の性質を示す代表的な物質である。強力な磁石を近づけると水が反発して逃れるように動く現象は,旧約聖書の逸話にちなみ「モーゼ効果」と呼ばれている。
● 水ほど多くの物質を溶解できる液体(溶媒)は他になく,特に無機化合物をイオンに分解して溶かす力は抜群である。電解質(イオン性の物質)に限らず有機物についても溶かすことができる。
● 水は,ヒドロニウムイオン( hydronium ion )と水酸化物イオン( hydroxide ion )に自己解離( self-ionization ;
イオンの活量(濃度)の積は,後述の溶解度積と同様に温度で決まる定数で,水の自己解離ではイオン積 Kw (ion product )といい,25℃,1気圧で Kw = [ H+ ] ・ [ OH- ] ≒ 1.008×10-14 mol2 L-2 である。
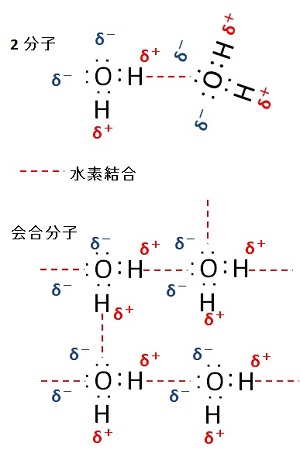
水分子の会合
水の構造
水分子( H2O )は,水素原子( H )と酸素原子( O )の価電子( valence electron )を 1つずつ共有して共有結合( covalent bond )を形成する。なお,酸素原子の最外殻には,共有結合に使われていない孤立電子対( lone pair ,非共有電子対; unshared electron pair )が 2つ存在する。
水素と酸素の電気陰性度( electronegativity )の違いから,O-H 結合において,共有電子対の偏りを原因として発生する電荷のひずみが生じ,酸素原子側が電気的に負,水素原子側が正となる局所的な電気双極子( dipole )を作る。
これにより,2つの水素原子が正の電荷を持ち,2つの非共有電子対が負の電荷を持つ。 さらに,水分子は,2つの O-H 結合が角度約 104.45°の折れ線構造になっているため,正の荷電の重心と負の荷電の重心が一致せず,分子全体として双極子を持つ極性分子となる。
複数の水分子が会合した液体では,2つの水素原子と 2つの非共有電子対の間で,複数の水素結合( hydrogen bond )を形成でき,3次元的な広がりを持つことができる。
この結果として,液体の中にクラスター状の高次構造(水クラスター)が生じる。この高次構造は,寿命が非常に短く(ピコ秒からフェムト秒オーダー),一度形成してもすぐ別の高次構造に移り変わると考えられている。
また,水分子は,水素イオン ( H+ ) の供給源として酸としての性質,水分子の酸素原子上の孤立電子対が塩基,配位子としての作用を示すため,水和物やアクア錯体と呼ばれる錯体( complex )を形成できる。
【参考】
錯体( complex )
配位結合や水素結合によって形成された分子の総称で,古くは錯塩( complex salt )と呼ばれていた。狭義には,金属と非金属の原子が結合した構造の化合物(金属錯体)をいう。
錯体は混合物とは異なり,特異な性質を持つ「純物質」として扱うことが可能なので,配位化合物( coordination compound ),錯化合物( complex compound )とも呼ばれる。
クラスター( cluster )
クラスターとは,葡萄の房,集団や群れを意味し,水クラスター( water cluster )とは,液体の中で複数の水分子が会合し,一団となっている様子を指す。水クラスターについて分かっていることはとても少なく,化学上の未解決問題のひとつである。
水の六量体,八量体から十量体までの水クラスターが観測されている。計算化学による検討で,複数のモデルが提案されているが,いずれのモデルも,水の特異性,例えば密度の変化を十分には説明できていない。
水クラスターの寿命は極めて短く,10-14 秒から 10-12 秒オーダーでの動的変化の観測報告がある。
ページのトップへ
溶媒の溶解パラメータ比較
溶解パラメータ
前項の【溶解度】で紹介したように,一般的に用いられる溶解パラメータ SP値( solubility parameter )は,溶解度パラメータ,ヒルデブラントの溶解パラメータ( Hildebrand solubility parameter )とも呼ばれる。ヒルデブラントの溶解パラメーター SP値(δ)は,正則溶液が成り立つ溶媒,すなわち,極性が無く,水素結合を持たない溶媒に適している。水などの極性溶媒や水素結合を持つ溶媒に対しては,これらを考慮したハンセンの溶解パラメーター( Hansen solubility parameter, HSP )が適している。
ハンセンの溶解パラメーター HSP値は,次の 3 つのパラメーター(分散力項,極性項,水素結合項)で構成されている。
分散力項(δD): 分子間の分散力によるエネルギー
極性項(δP) : 分子間の双極子相互作用によるエネルギー
水素結合項(δH) : 分子間の水素結合によるエネルギー
なお,ヒルデブラントの溶解パラメーター SP (δ)とハンセンの溶解パラメーター HSP(δD,δP,δH)には,次の関係がある。
δ2 = δD2 +δP2 +δH2
下表には,溶媒として用いられる主な化合物の溶解パラメータを紹介する。表から明らかなように,水がいかに特異な溶媒であるかが分かる。
| 物質分類 | 物質名 | 示性式・分子式 | ヒルデブラント δ |
分散 δD |
極性 δP |
水素結合 δH |
|---|---|---|---|---|---|---|
| 水酸基(ヒドロキシル基) を持つ化合物 |
水 | H2O | 47.8 | 15.6 | 16.0 | 42.3 |
| メタノール | CH3-OH | 29.2 | 15.1 | 12.3 | 22.3 | |
| エタノール | CH3CH2-OH | 26.4 | 15.8 | 8.8 | 19.4 | |
| 1-プロパノール | CH3(CH2)2-OH | 24.5 | 16.0 | 6.8 | 17.4 | |
| 2-プロパノール (イソプロピルアルコール) |
CH3CH(OH)CH3 | 23.5 | 15.8 | 6.1 | 16.4 | |
| 1-ブタノール | CH3(CH2)3-OH | 23.5 | 16.0 | 5.7 | 15.8 | |
| 1-ペンタノール | CH3(CH2)4-OH | 21.7 | 16.0 | 4.5 | 13.9 | |
| 1-ヘキサノール | CH3(CH2)5-OH | 21.9 | 15.8 | 4.5 | 13.9 | |
| 極性溶媒 | アセトン | CH3(CO)CH3 | 20.0 | 15.5 | 10.4 | 7.0 |
| アセトニトリル | CH3CN | 24.0 | 15.3 | 18.0 | 6.1 | |
| アニリン | C6H5NH2 | 22.6 | 19.4 | 5.1 | 10.2 | |
| N,N-ジメチルホルムアミド(DMF) | (CH3)2NCHO | 24.8 | - | - | - | |
| 芳香族炭化水素 | ベンゼン | C6H6 | 18.7 | 18.4 | 0 | 2.0 |
| メチルベンゼン (トルエン) |
C6H5CH3 | 18.2 | 18.0 | 1.4 | 2.0 | |
| 1,2-ジメチルベンゼン ( o-キシレン) |
C6H4(CH3)2 | 18.4 | 17.8 | 1.0 | 3.1 | |
| エチルベンゼン | C6H5C2H5 | 18.0 | - | - | - | |
| 脂肪族炭化水素 | メタン | CH4 | 9.6 | - | - | - |
| エタン | C2H6 | 11.6 | - | - | - | |
| プロパン | CH3(CH2)CH3 | 12.7 | - | - | - | |
| ヘキサン | CH3(CH2)4CH3 | 14.8 | 14.9 | 0 | 0 | |
| シクロヘキサン | C6H12 | 14.8 | 14.9 | 0 | 0 | |
| 他溶媒(水素結合 弱) | ジクロロメタン (塩化メチレン) |
CH2Cl2 | 19.8 | - | - | - |
| トリクロロメタン (クロロホルム) |
CHCl3 | 19.0 | - | - | - | |
| 他溶媒(水素結合 中) | エトキシエタン (ジエチルエーテル) |
CH3CH2 O CH2CH3 | 15.1 | - | - | - |
| 酢酸エチル | CH3C(O) O CH2CH3 | 18.6 | - | - | - |
Handbook of Solybility Parameters and Other Cohesion Parameters, second Edition, A.F.M. Barton, CRC Press (1991) など
溶解パラメータの単位には,当初から用いられる ( cal・cm-3 )1/2 の他に,SI単位系を用いた MPa1/2 が用いられ,混在しているのが現状である。
なお,1 cal・cm-3= 4.18605 J・cm-3= 4.18605 N・m・cm-3= 4.18605×106 N・m-2= 4.18605 MPa,従って,1 ( cal・cm-3 )1/2 = 2.04598 MPa1/2 となる。
ページのトップへ
無機塩の水への溶解について
広く経験される食塩(塩化ナトリウム)など無機塩の水への溶解についてその概要を紹介する。
無機塩とは
炭素の酸化物や炭酸塩を除く炭素を含む化合物,すなわち有機化合物( organic compounds )以外の化合物の総称を無機化合物( inorganic compounds )という。
無機化合物の中で無機酸と無機塩基の酸・塩基反応( acid-base reaction )で得られた化合物(塩),又は無機酸の水素を金属で置換した化合物を無機塩( inorganic salt,mineral )という。
すなわち,無機塩は,正の電荷を持った金属原子,又は分子(陽イオン: cation,positive ion )と負の電荷を持った無機元素の原子,又は分子(陰イオン: anion,negative ion )とが静電気力(クーロン力,静電的引力と静電的斥力)によってできるイオン結合( electrovalent bond )で構成された化合物である。
塩化ナトリウムの溶解挙動
無機塩の溶解現象を理解するため,最も身近で挙動が単純な塩化ナトリウムの水への溶解について紹介する。
塩化ナトリウム( NaCl )結晶は,【イオン結晶構造】で紹介したように,正の電荷を持つナトリウムイオン( Na+ )と負の電荷を持つ塩化物イオン( Cl- )が交互に整然と配列している。
塩化ナトリウム結晶を水に浸漬すると,結晶表面に水分子が吸着( adsorption )する。上述の水の構造で紹介したように,分子内に電荷の偏り(双極子)がある。
このため,正の電荷を持つナトリウムイオン( Na+ )には,負に分極している水分子の酸素原子が,負の電荷を持つ塩化物イオン( Cl- )には,正に分極した水分子の水素原子が強く引き付けられる。これを溶媒和(水の場合は水和)という。
塩化ナトリウムなどの自発的に溶解する塩の溶解のギブス自由エネルギー変化が負(発エルゴン反応)の塩では,溶媒和(水和)のエネルギーが,イオン結晶の格子エネルギーに匹敵するほど大きいので,固体表面に水が吸着することで,ナトリウムイオンと塩化物イオンの間の結合が弱まり,周りを水分子で囲まれたイオン(水和イオン)として水中に拡散することができる。
なお,固体として残る塩化ナトリウムや水溶液は,それぞれに電気的な中性を保つため,離脱する陽イオンと陰イオンの数は同じでなければならない。
これが次々と起こり,塩化ナトリウムが水に溶解することになる。

塩化ナトリウムの溶解(イメージ図)
参考
ギブズエネルギー変化が負で自発的に起きる反応を発エルゴン反応( exergonic reaction )といい,ギブズエネルギー変化が正で自発的に起きない反応は吸エルゴン反応( endergonic reaction )という。
吸エルゴン反応は,加熱,電気分解,他の発エルゴン反応との組み合わせなど,外部から仕事を与えなければ進行しない反応である。他の発エルゴン反応と組み合わせることを共役という。
無機塩の溶解度
主な無機塩(イオン化合物)の 25℃における水に対する溶解度の例を下表に示す。表を見て分かるように,水中でイオンに解離する物質であるが,溶媒量を凌ぐほど多量に溶ける物質から極少量しか溶けない物質まで様々である。
なお,表に示した塩より難溶性の塩については,溶解度での表記ではなく,温度で決まる定数である溶解度積(溶解度定数)で表記するのが一般的である。
| 物質名 | 化学式 | 式量 | 溶解度 | 物質名 | 化学式 | 式量 | 溶解度 |
|---|---|---|---|---|---|---|---|
| 塩化亜鉛 | ZnCl2 | 136.3 | 412.3 | 塩化カリウム | KCl | 74.55 | 35.8 |
| 硝酸銀 | AgNO3 | 169.87 | 239.3 | 炭酸ナトリウム | Na2CO3 | 105.99 | 29.4 |
| 水酸化カリウム | KOH | 56.11 | 118.3 | 炭酸水素ナトリウム | NaHCO3 | 84.01 | 10.3 |
| 水酸化ナトリウム | NaOH | 40.0 | 113.8 | 硫化バリウム | BaS | 169.4 | 9.0 |
| 塩化銅(Ⅱ) | CuCl2 | 134.46 | 75.0 | 炭酸カルシウム | CaCO3 | 100.1 | 0.81 |
| 塩化鉄(Ⅱ) | FeCl2 | 126.75 | 64.2 | 硫酸カルシウム | CaSO4 | 136.14 | 0.208 |
| 塩化マグネシウム | MgCl2 | 95.21 | 55.2 | 水酸化カルシウム | CaOH | 74.09 | 0.169 |
| 塩化アルミニウム | AlCl3 | 133.34 | 46.8 | 硫酸バリウム | BaSO4 | 233.39 | 0.000268 |
| 塩化ナトリウム | NaCl | 58.44 | 35.9 | 塩化銀 | AgCl | 143.32 | 0.000193 |
【参考】
溶媒和( solvation )
溶液中においてイオン又は溶質分子に溶媒分子が結合する現象。【 JIS K 0211「分析化学用語(基礎部門)」】
溶質分子や電離して生じたイオンが静電気力や水素結合などで溶媒分子と相互作用しながら拡散する現象である。溶媒が水の場合には,特に水和( hydration )という。
極性溶媒にイオン性物質や極性物質が溶けやすいのは溶媒和による。極性溶媒に無極性物質が溶けにくいのは,溶媒和がほとんど起こらないためである。
なお,無極性溶媒の場合には,溶媒和とは言わない。
ページのトップへ
溶解度積
溶解度積( solubility product )【 JIS K 0211「分析化学用語(基礎部門)」】
ある溶液中で難溶性塩(固体)がその塩の構成イオンと平衡に
あるとき,構成イオンの濃度又は活量の積。
注記 Am Bn の塩では,[An+] m [Bm-] n で与えられる。ここで[ ]内は物質量濃度を表す。
溶解度積の記号は,solubility product の頭文字を添え字にした Ksp を用いるのが一般的である。なお,溶解度積は,濃度溶解度積,溶解度定数ともいわれ,物質量濃度(モル濃度 molarity :単位 mol / L )で表したイオン活量(濃度)の積で表す。
溶解度積は温度で決まる定数で,イオンの沈殿条件を求める上で重要な指標で,溶液中のイオン濃度の積が溶解度積を超えたときに沈殿し始める。
溶解度積と溶解度の関係
Am Bn の塩では,
Am Bn ⇔ m An+ + n Bm-
の溶解平衡に至るので,溶解度(χ)と溶解度積( Ksp )と各イオンの活量とには,mχ= [An+] ,nχ= [Bm-] ,Ksp = [An+] m [Bm-] n の関係が得られるので,溶解度(χ)と溶解度積( Ksp )は,
Ksp = mm nn χ( m + n )
となる。
難溶性塩の溶解平衡
難溶性の塩を水に加えると,一部が溶け出してイオンが生成する。次第に塩の溶解速度と析出速度が釣り合い,化学平衡(溶解平衡,電離平衡)に至る。
難溶性塩 Am Bn を水に加えて溶解平衡(化学平衡)にある時,
Am Bn ⇔ m An+ + n Bm-
が成り立つ。溶解平衡のある温度での平衡定数 K は,
K = { An+ } m { Bm- } n / { Am Bn }
で表される。なお,{ An+ } ,{ Bm- } ,{ Am Bn } は,それぞれの成分の活量(活動度)である。
難溶性の塩の溶解では,希薄溶液と考えられるので,イオンの活量は,濃度(モル分率)に等しいとしてよい。すなわち,{ An+ } = [ An+ ] ,{ Bm- } = [ Bm- ] とできる。
従って,溶解の平衡定数は
K・ { Am Bn } = [ An+ ] m [ Bm- ] n = Ksp
となる。ここで,溶液平衡にある固体の活量 { Am Bn } を 1 とできるので,溶解度積 Ksp は,平衡定数 K と同様に,温度で一義的に決まる定数であることが分かる。
平衡定数 K は,反応系のギブズ自由エネルギー変化(Δ G )と
ΔG =-RT ln K
ここに,R :気体定数,T :熱力学的温度
の関係にあるので,難溶性塩の溶解度積 Ksp は,
Ksp = exp ( -ΔG /RT )
の関係になる。
実用上では,難溶性塩の溶解度は著しく小さいため,重量測定ができない。このため,上式のΔG から Ksp を求めるのが通例である。
具体的には,ギブズ自由エネルギー変化(Δ G )と電極電位( E )の関係
ΔG =-nF E
ここに,n :関与する電子の数,F :ファラデー定数( 96,485 C mol-1 )
を用いて溶解度積を求めることができる。
| 物質名 | 溶解度積 | Ksp 値 | 物質名 | 溶解度積 | Ksp 値 |
|---|---|---|---|---|---|
| 塩化銀( AgCl ) | [Ag+] [Cl-] | 1.7×10-10 | 臭化銀( AgBr ) | [Ag+] [Br-] | 4.3×10-13 |
| 硫酸カルシウム( CaSO4 ) | [Ca2+] [SO42-] | 4.1×10-5 | 硫酸バリウム( BaSO4 ) | [Ba2+] [SO42-] | 1.7×10-10 |
| 炭酸カルシウム( CaCO3 ) | [Ca2+] [CO32-] | 4.96×10-9 | 炭酸バリウム( BaCO3 ) | [Ba2+] [CO32-] | 2.58×10-9 |
| 水酸化鉄(Ⅱ)Fe(OH)2 | [Fe2+] [ OH-]2 | 4.87×10-17 | 水酸化鉄(Ⅲ)Fe(OH)3 | [Fe3+] [ OH-]3 | 2.64×10-39 |
| 硫化鉄(Ⅱ)FeS | [Fe2+] [ S2-] | 1.59×10-19 | 硫化銅(CuS) | [Cu2+] [ S2-] | 1.27×10-36 |
| 硫化水銀(HgS) | [Hg2+] [ S2-] | 3.0×10-52 | 硫化亜鉛(ZnS) | [Zn2+] [ S2-] | 2.9×10-25 |
【参考】
化学平衡( chemical equilibrium )
可逆反応において正反応の進行速度と逆反応の進行速度とが釣り合って,見かけ上反応が停止した状態。
固体状態の化合物がその化合物の溶液と化学平衡にあるときに溶解平衡( dissolution equilibrium , solubility equilibrium )ともいう。
電解質溶液中で電離してできたイオンと電離していない分子との間に成立する化学平衡を電離平衡( electrolytic dissociation equilibrium , ionic equilibrium , ionization equilibrium )ともいう。なお,イオン平衡( ionic equilibrium )と呼ばれることもある。
活量( activity )
活量は,ギルバート・ニュートン・ルイス( Gilbert Newton Lewis )によって導入された物理量で,a と表される。活動度と呼ばれる場合もある。
反応の平衡や速度を議論するときに使われる濃度の有効値を指す。なお,一般的には,簡便のため,活量をつぎのように扱うことが多い。
1)希薄溶液において,イオン,分子もその活量は,濃度(モル分率)に等しいとしてよい。すなわち,活量係数 γ= 1 として扱われる。
2)希薄溶液において,溶媒の活量を 1 として差し支えない。
3)溶液と平衡状態にある純粋の固体又は液体の活量を 1 として差し支えない。
4)溶液と平衡関係にある気体の活量は,その気体の分圧に等しい。
5)混合液体の平衡を考える場合,その一成分の活量は,そのモル分率に等しい。
ギルバート・ニュートン・ルイスは,アメリカ合衆国の物理化学者( 1875 ~ 1946年)で,共有結合の発見(ルイスの電子式),ラジカル(不対電子対)の定義,酸・塩基の定義(ルイス酸・塩基),熱力学の再構築による化学熱力学の提唱,光化学実験,光子( photon )の命名などで知られる。
活量係数( activity coefficient )
理想とする数値(活量)からのずれを表す指標として,活量係数γが定義される。i 成分の活量 ai と理論上のモル分率χi の間には次の関係にある。
a i = γi χi
ページの先頭へ