第一部:化学と物質構造・その他の結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,水素結合による分子の凝集を理解するため,【分子の構造と双極子】, 【メタン,アンモニア】, 【フッ化水素】, 【水】 に項目を分けて紹介する。
分子の構造と双極子
【水素結合の影響】では,周期表第 14 族から第 17 族までの元素の水素化物の固体,液体の融点(℃),及び沸点(℃)の関係を紹介し,周期表第 2 周期の元素の水素化物において,分子の凝集における水素結合の影響により特異な値を示すことを紹介した。
第 2周期の元素は,水素の電気陰性度 2.1 に比較し,炭素( C )は 2.5 と大差ないが,窒素( N ) 3.0 ,酸素( O ) 3.5 ,ふっ素( F ) 4.0 と水素との差が大きい。ここでは,それぞれの元素の単純な化合物であるメタン,アンモニア,フッ化水素,水を例に水素結合の影響を紹介する。
双極子(dipole )
双極子とは,分子内に生じた電子の偏りを原因として発生する電荷のひずみである。すなわち,分子構造の中で,正の電荷の重心と負の電荷の重心が一致しない電荷の配置をいう。
メタン,アンモニア,フッ化水素,水では,下図に示すように,第 2周期の元素と水素との電気陰性度の差とそれぞれの分子構造により分子内に電荷の偏りが発生する。
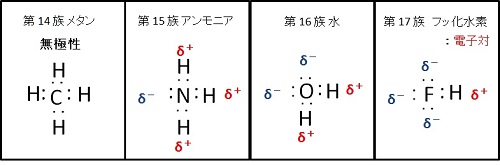
第 2 周期元素の水素化物の構造と双極子
ページのトップへ
メタン,アンモニア
メタン( CH4 )
周期表第 14族の炭素( C )の水素化物であるメタンは,両元素間の電気陰性度の差が小さいうえ,電子対がすべて共有されている。さらに,水素が炭素を中心に対称の位置に存在する正四面体構造のため,双極子が発生せず,分子はファンデルワールス力のみで凝集する。
アンモニア( NH3 )
周期表第 15族の窒素( N )の水素化物であるアンモニアは,3つの共有電子対と 1つの非共有電子対を持つ。
水素と窒素の電気陰性度の差が比較的大きく,アンモニア分子は非対称の構造となるため,双極子が発生する。すなわち,3つの共有電子対は,電気陰性度の大きい窒素原子に引寄せられ,1つの非共有電子対の方向に負の電荷帯び,反対側の水素原子が正の電荷を帯びた分子になる。
複数の分子が会合する場合は,負に帯電した非共有電子対と正に帯電した水素原子とで水素結合するが,水素原子の数が非共有電子対より多いので,水素結合に寄与しない水素原子同士の反発があり,静電的なバランスが取れるように,結合に関与しない水素原子が離れた折れ線状の会合分子になると考えられる。
ページのトップへ
フッ化水素( HF )
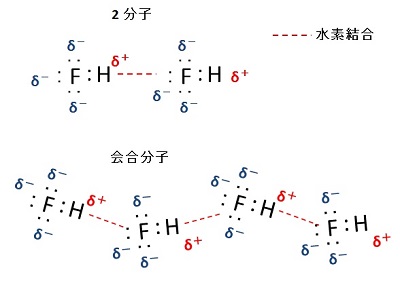
フッ化水素分子の会合
水素とふっ素の電気陰性度の差が大きく,双極子が発生する。すなわち,水素原子が正の電荷を持ち,3つの非共有電子対が負の電荷を持つ。
複数の分子が会合する場合は,負に帯電した非共有電子対が水素原子より多いので,水素結合に寄与しない非共有電子対同士の反発がある。このため,静電的なバランスが取れるように,右図のように,正に帯電した水素原子を介して折れ線状(約 140°)に引き合い,複数のフッ化水素分子で形成される会合分子になると考えられる。
フッ化水素と同じ周期表第 17族で,第 3周期の塩素の水素化物である塩化水素( HCl )は,塩素の電気陰性度が 3.5 と酸素と同等であるが,軌道電子の数が多く(原子サイズが大きい)共有電子対の偏りの影響が酸素より小さいと考えられ,結果として融点,沸点に大きく影響するほどの水素結合には至っていないと考えられる。
ページのトップへ
水( H2O )
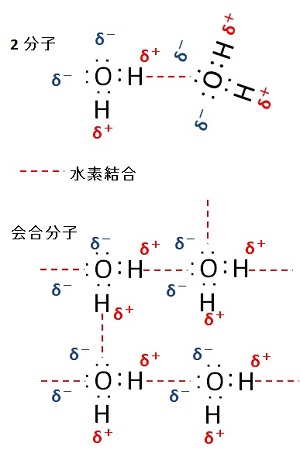
水分子の会合
水素と酸素の電気陰性度の差が比較的大きく,非対称の分子構造のため,双極子が発生する。すなわち,2つの水素原子が正の電荷を持ち,2つの非共有電子対が負の電荷を持つ。
2分子が会合した状態では,電荷のバランスを取るように,一つの水素原子を介して近接する。
複数の水分子が会合した場合には,右図に示すように,2つの水素原子と 2つの非共有電子対の間で,複数の水素結合を形成でき,3次元的な広がりを持つように会合できる。
酸素の電気陰性度はふっ素原子より小さいが,水素結合に寄与する水素原子が多いので,フッ化水素より沸点がより大きく上昇する。
なお,液体状態の水では,図にあるように,水素結合に預からない水素原子と非共有結合が少なからず存在し,自由に回転・移動ができる水分子の集団を形成する。
液状の水の温度低下で複数の水素結合が容易になり水分子の会合が進むとともに,水分子の熱運動量も減る。この結果として,液状の水の体積が減少する。
しかしながら,約 4℃で液体の体積が最小になり,さらに温度が低下すると,液体の体積が増加する。
この現象は,温度低下により,水素結合する箇所が増加し,水分子の自由な回転・移動が制約され,3次元的な水素結合による正四面体状のすき間の多い構造が多く占めるようになるためと考えられる。
すなわち,4℃以下の水では,凝固後を含めて温度低下により体積増加(密度の減少)といった特有の現象を示す。
ページの先頭へ