第一部:化学と物質構造・共有結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,分子軌道理解のための具体例として,【水素の分子軌道】, 【酸素の分子軌道】, 【結合次数とは】 に項目を分けて紹介する。
水素の分子軌道
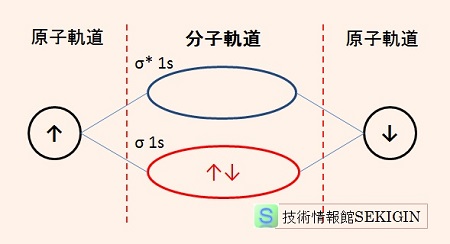
水素分子の電子配置
水素分子( H2 )では,結合性分子軌道(σ1s )と反結合性分子軌道(σ* 1s)に分かれ,結合に関与する 2個の電子は,エネルギー順位の低い結合性分子軌道を埋めることができ,分子として安定する。
【参考】
分子軌道( molecular orbital )
単原子分子(希ガス)を除き,複数の原子で分子を構成した場合には,結合に関与した電子は,原子間距離に応じて,一つ以上の原子核と相互作用をもつ分子軌道で記述される。
エネルギー準位( energy level )
量子力学によれば,複数の粒子が引力によって結合している系(分子,原子,原子核など)のエネルギーは,一連のとびとびの値をとる。これを水準の高低になぞらえてエネルギー準位という。
各エネルギー準位には一つまたは何個かの定常状態が対応する。複数の状態が対応するとき,準位が縮退(degeneration)しているという。
定常状態を単にエネルギー準位という場合もある。最低のエネルギー準位に対応する状態を基底状態,それより高いエネルギーの状態を励起状態という。(世界大百科事典)
パウリの排他原理( Pauli principle )
パウリにより提唱された原理で,排他律あるいは禁制原理などとも呼ばれる。
「 2つ以上のフェルミ粒子は,同一の量子状態を占めることはできない。」と表現され,一つの原子内では,2個以上の電子が同時にエネルギー・スピンなどの同じ状態をとることはないことを示す原理である。
ページのトップへ
酸素の分子軌道
酸素原子は,原子番号 8で,電子として 1s軌道に 2個(電子対),2s軌道に 2個(電子対),2p軌道に 4個(電子対 1 ,不対電子 2 )存在する。
酸素分子( O2 )では,原子核に近い 1s軌道の電子は,結合形成にほとんど影響しない。
しかし,2つの酸素原子が近づくと,2s軌道が重なり合うことができ,上記の水素の場合と同様に結合性分子軌道(σ2s )と反結合性分子軌道(σ* 2s )が形成される。
方位量子数 1の 2p軌道は,磁気量子数 m = -1 , 0 , 1 の 3つの軌道をとれる。それぞれの軌道は,互いに垂直の関係にある。このため,この軌道の中の 1つ( 2px とする)が 2つの原子を結ぶ軸の方向を向く(σ結合)と他の 2つの軌道( 2py , 2pz とする)は軸に対して垂直の方向を向く(π結合)ことになる。
従って,2p軌道には,結合性分子軌道(σ2px ,π2py ,π2pz )と反結合性分子軌道(σ* 2px ,π* 2py ,π* 2pz )が形成される。
それぞれのエネルギー順位は,σ2s <σ* 2s <σ2px <π2py =π2pz <π* 2py =π* 2pz <σ* 2px となり,16個の電子がエネルギー順位の低い軌道から分配され,π2pzまでは 7組の電子対( 14個)で満たされる。
残りの 2個の電子は,不対電子として 1個ずつπ* 2py とπ* 2pz に分配される。
原子軌道と分子軌道の電子配置のイメージ図(下図)に示すように,原子軌道の 2p軌道より 6個の電子が低いエネルギー状態の分子軌道に,2個の電子が高いエネルギー状態の分子軌道に配置され,電子全体としてはエネルギーが低く安定であることが分かる。
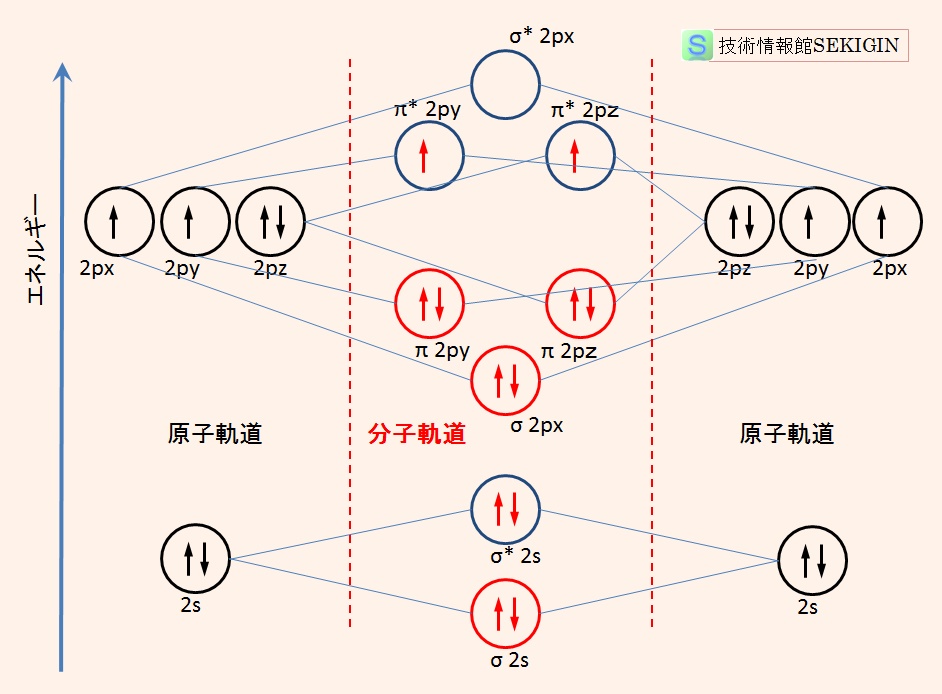
酸素分子の電子配置
ページのトップへ
結合次数とは
分子軌道論における正味の結合性を簡単に決めるために,結合次数( bond order )が用いられる。
結合次数は,結合性分子軌道にある電子数(酸素分子の場合 はσ2px ,π2py ,π2pz の 8 個)と反結合性分子軌道の電子数(酸素分子の場合はσ*2px ,π*2py ,π*2pz に含まれる 4個)の差(酸素の場合は,8 - 4 = 4個)の半分である。
従って,酸素分子の場合は,結合次数 2 ( = 4 / 2 )となる( 2 重結合)。
ページの先頭へ