第二部:物質の状態と変化 希釈溶液の性質
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,理想溶液に準じる理想希薄溶液の束一的性質として知られる凝固点降下現象について,【凝固点降下の熱力学的扱い】, 【凝固点降下の具体例】, 【溶液濃度と凝固点】 に項目を分けて紹介する。
凝固点降下の熱力学的扱い
溶媒に不揮発性の溶質を入れた溶液では,沸点上昇と同様に,凝固点も降下する。この現象は日常生活で広く用いられている。一方で,誤解した使用も多い。
例えば,水とエタノールの混合液体(酒)は,水の凝固点より低く,高濃度の酒は冷凍庫でも凍結しない。これを水の凝固点降下と誤解されやすいが,これは凝固点 -114.3℃のエタノールと水の混合液体の特性であり,凝固点降下現象ではない。エタノール側からみると凝固点は上昇しているのである。
凝固点降下( depression of freezing point )
不揮発性溶質がわずかに溶けた希薄溶液は,理想溶液に準じた物質の移動を伴う開いた系の熱力学による扱いができる。熱力学の基本については,【基礎物理】で紹介する。ここでは凝固点降下の熱力学的扱いの結論についてのみ紹介する。
凝固点降下は,前項の【沸点上昇】と同様に,蒸気圧が溶媒より著しく低い溶質(不揮発性溶質)が溶けた溶液で観察される束一的性質( colligative properties )と呼ばれる現象である。
はじめに,断熱容器の中が,氷と水の共存で平衡状態にあるとする。すなわち,氷の融解熱により,断熱容器内の温度が下がり,水溶液中の水分子と氷の化学ポテンシャルが等しくなり,平衡状態に達すると考えられるので,沸点上昇と同じ扱いができる。
この結果として,凝固点降下度(ΔT )は,
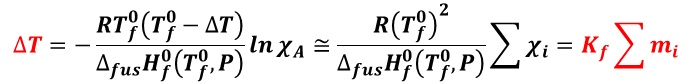
となる。すなわち,凝固点降下度(ΔT )は,沸点上昇度と同様に,溶質のモル濃度( mi )の総和に比例し,比例係数(モル凝固点降下 Kf )は溶媒の性質のみで決まる。
【参考】
化学ポテンシャル( chemical potential )
化学ポテンシャルは,アメリカの化学者ウィラード・ギブズ( 1839 ~ 1903 年)により導入された概念で,物質の量により潜在的に系の持つエネルギーの大きさの尺度となる量。
束一的(そくいつてき)性質( colligative properties )
不揮発性溶質の希薄溶液における性質で,溶質分子の数だけに依存する性質。束一的性質を持つ現象には,蒸気圧降下,沸点上昇,凝固点降下,浸透圧,ヘンリーの法則がある。
フガシティー( fugacity )
フガシティー( f )は,逃散能,散逸能と訳され,物理化学の分野で圧力の高い実在気体の化学平衡を扱うときにも理想気体の化学ポテンシャルの形式が成り立つようにする意図で導入された概念である。
フガシティー( f )の概念で凝固点降下は,少量の溶質を加えた時,水溶液中の水分子は,氷よりフガシティー( f )が減るため,氷の一部が溶けて水になると考える。
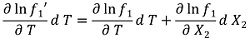
𝑓1':氷のフガシティー, 𝑓1 :水溶液中の水のフガシティー, X2 :溶質のモル分率
融解熱( heat of fusion )
一定の量の物質が固体から液体に相転移する時に必要な熱量で,気化熱と共に潜熱( latent heat )に分類される。
ページのトップへ
凝固点降下の具体例
凝固点降下は,【相転移(状態変化)】で紹介した相図での変化で容易に理解できる。
溶媒の相図における蒸気圧低下の影響は,水について模式的には図のように考えられる。
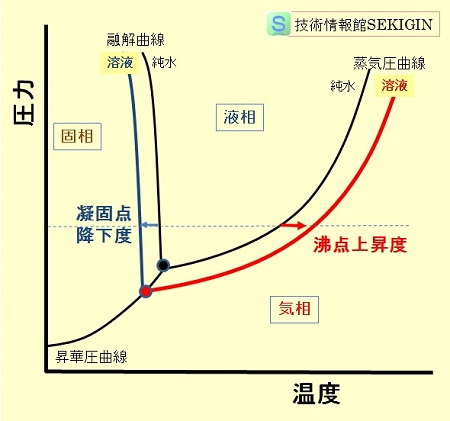
水の蒸気圧低下の影響(模式図)
凝固点降下についても同様に考えることができ,希薄溶液の凝固点降下度(⊿ T :K ケルビン )は,比例係数を Kf と,溶質の質量モル濃度 m ( mol / kg )とに次の関係がある。
⊿ T ≒ Kf m
ここで, Kf はモル凝固点降下といい,溶媒の種類に依存するが,溶質の種類には依存しない値である。単位は K・kg / mol である。
また,溶質が電解質の場合は,沸点上昇と同様に,質量モル濃度 mについては,【沸点上昇】で紹介したファントホッフの因子を導入した補正が必要である。
| 溶媒名 | 化学式 | 分子量 | 凝固点(℃) | モル凝固点降下 (K・kg/mol) |
|---|---|---|---|---|
| アンモニア | NH3 | 17.03 | -77.73 | 0.98 |
| 水 | H2O | 18.02 | 0.00 | 1.85 |
| 酢酸 | CH3COOH | 60.05 | 16.7 | 3.9 |
| クロロホルム | CHCl3 | 119.4 | -64 | 4.9 | ベンゼン | C6H6 | 78.11 | 5.5 | 5.12 | シクロヘキサン | C6H12 | 84.16 | 6.5 | 20.2 |
| 四塩化炭素 | CCl4 | 153.82 | -22.9 | 29.8 |
ページのトップへ
溶液濃度と凝固点
溶液を冷却し,溶液の濃度に応じた凝固点に達すると,凝結が開始する。ここで凝結する固体は,溶液の固体ではなく,純溶媒の固体である。
例えば,海が冷えてできた海氷(流氷など)は,氷の成長段階では,基本的に塩分を含まない氷ができる。実際には,氷の間隙への海水の取り込み,共晶混合物の生成などで,流氷などを採取して分析すると低濃度であるが塩を検出できる。
溶液の温度を下げ,凝固点に達すると,凝固が始まる。この段階で,純溶媒の固体ができるため,残った溶液中の溶媒の量が減少することになる。すなわち,溶液中の溶質濃度が徐々に増加することになる。従って,残された溶液の凝固点がさらに低下する。
温度の低下で,残された溶液の溶質濃度が飽和濃度に達した段階で,溶媒の固体と溶質の固体が一緒に晶出してくる。この段階でできた混合固体を共晶混合物( eutectic )といい,この時の温度を共融点( eutectic temperature )という。
例えば,1 ㎏ の水に 35g の塩化ナトリウム( NaCl )を加えた塩化ナトリウム水(塩水)を冷却してゆく場合を考えみる。
塩化ナトリウムのモル質量が 58.44 g / mol で,塩水の溶質の質量モル濃度は,0.6 mol / kg(= 35 / 58.44 )となる。高濃度ではあるが,簡単のため,活量係数γ= 1 ,電離度α= 1 ,モル凝固点降下 Kf = 1.85 と仮定し,水溶液の凝固点降下を求めると,⊿ T = 0.6 × 2 × 1.85 = 2.22 ( K )となる。すなわち,水の凝固点(氷点)は,0 ℃であるが,この塩水は, -2.2 ℃で凝固が始まることになる。
凝固が進み,残された塩水の濃度が増加し,塩化ナトリウムの飽和濃度( 35.9 g / 100g H2O ,6.14 mol / kg )に達する。この濃度での凝固点降下は,⊿ T = 6.14 × 2 × 1.85 = 22.7 ( K )となり,溶液の温度は,-22.7 ℃まで下がる。
この温度が塩水の共融点(実測値は -21.3 ℃)で,残された塩水が共晶混合物(氷と塩の微細な結晶の混合物)として凝結する。
この現象は,氷に多量の塩を混ぜ,氷の融解熱で共融点まで冷却する寒剤として,冬季の道路の凍結温度を下げるため,共融点の低い塩化ナトリウムや塩化カルシウム(共融点: -49.8 ℃)の散布などに利用される。
【参考】
海氷( sea ice )
海水が凍結したもの。海水は塩分を含む(約 3.5 %)ので,氷点は - 1.8 ℃ほどである。海氷には,沿岸にそって凍り沖へ広がった定着氷( fast ice )と,岸から離れて漂流する流氷( pack ice )がある。なお,浮かんでいる海氷の塊で最大径が 10 km より小さいものを氷盤( ice floe ),それより大きいものを氷原( ice field )と呼ばれる。
海氷は,陸上でできた棚氷や氷河が分離した氷山とは異なるものである。
ページの先頭へ