第二部:物質の状態と変化 気体の圧力
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,気体圧力の理解のために,【気体分子の熱運動】 について紹介する。
気体分子の熱運動
気体は,粒子(分子,原子)間の距離が長く,粒子間の相互作用をほとんど受けず,熱運動の影響のみを受ける。
気体に熱を与えると,エネルギー保存の法則(熱力学第一法則)に従い,熱量( Q )は,仕事( W )と内部エネルギー( U ;粒子の運動エネルギーの総量)の和になる。
δU = δQ -δW
δU :内部エネルギーの変化量,δQ :外から与えられた熱量,δW :系外に取り出される仕事
【熱運動】で紹介したように,気体の粒子の運動は,並進運動(一定速度での直進運動),回転運動,分子内振動に分けられる。
気体では粒子間の相互作用が小さいので,閉じられた系などの外に対する仕事が小さい場合には,与えられた熱は並進運動の増加使われると考えてよい。
すなわち,粒子の質量( m )は変わらないので,与えられた熱エネルギー( E )は,粒子の並進運動の速度( ν )の増加( E = 1 / 2・mν2 )になる。
気体は多数の粒子の集合体のため,粒子間の距離が離れているとはいえ,粒子同士の衝突がある。気体を構成する原子や分子の衝突は,完全弾性衝突( perfectly elastic collision )と考えられるので,衝突により互いのエネルギーを交換する。
すなわち,一つの粒子に注目した時,ある時に速度 ν1 で移動し,衝突後に速度 ν2 に変わる。これを繰り返しながら存在することになる。従って,ある温度の気体は,幅広い速度分布(マクスウェル分布)を持った粒子の集まりで,粒子の速度はその平均値でしか表せないことになる。
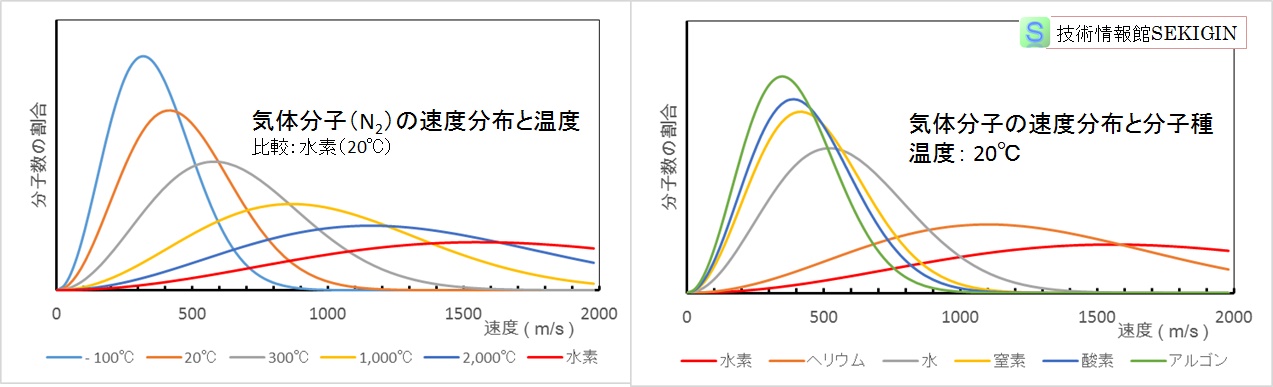
下図には,窒素分子( N2 )の温度と分子速度の関係,温度 20℃での各種気体分子( H2 ,He,H2O ,N2 ,O2 ,Ar )の速度分布の計算結果を示す。計算には,ボルツマン定数( 1.3806×10-23 ),質量として窒素( 4.6872×10-26 kg ),水素( 3.348×10-27 kg ),ヘリウム( 6.696×10-27 kg ),水( 2.99×10-26 kg ),酸素( 5.3568×10-26 kg ),アルゴン( 6.6876×10-26 kg )を用いた。
図から,気体分子は,温度が高いほど,分子量が小さいほど,速度分布が広くなり,ピーク速度と平均速度が大きくなることが分かる。
気体分子の速度分布
【参考】
マクスウェル分布( Maxwell distribution )
熱力学的平衡状態で気体分子の速度が従う分布関数(マクスウェル-ボルツマン分布:Maxwell - Boltzmann distribution ともいう)である。
ここで,分子の質量 m ,ボルツマン定数 k ,温度(ケルビン) T とすると,分子速度νの分布は,次の分布式で表せる。
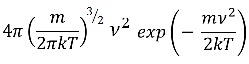
マクスウェル速度分布式
衝突( collision )
運動している 2 つの物体が接触し,短時間に力を相互に及ぼし合う物理的現象をいう。 2 つの物体が衝突した時,衝突前の一方の物体の相対速度をνとすると,衝突後の相対速度ν’は,ν’= - e νとなる。
e は反発係数と呼ばれ,0 から 1 の間の値を取る。e = 1 であれば運動エネルギーが保存されるので,完全弾性衝突( perfectly elastic collision )といわれる。完全弾性衝突以外は,運動エネルギーの一部が熱エネルギーなどに変換される。
ページの先頭へ