第二部:物質の状態と変化 熱運動と状態変化
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
気体,液体,及び固体(三態)は,温度や圧力を変えることで,状態が相互に変化(相転移)する。
ここでは,相転移について,【固体・液体間の変化】, 【固体・気体間の変化】, 【液体・気体間の変化】, 【相図とは】 に項目を分けて紹介する。
固体・液体間の変化
粒子(原子,分子)で構成される固体は,粒子間の距離が小さく,引力(ファンデルワールス力など)で規則正しく配列している。
固体を加熱することで,粒子の熱振動が激しくなり,固体表面の粒子の一部が引力に抗して配列から離脱し流動を開始(液体に変わる)する。
粒子の配列が徐々に崩れてゆくが,外から与えられたエネルギーがこのために消費されるので,固体がすべて液体に変わるまでの温度はほぼ一定に保たれる。
液体から熱を奪う(冷やす)場合は,逆の過程を経て固体に変わる。
固体 ⇒ 液体
固体が液体に変わる現象を融解( melting , fusion )といい,変化している間は,熱を与えても温度が一定に保たれ,この温度を融点( melting point )という。固体が液体に変化するときに吸収する熱エネルギーを融解熱( heat of fusion )という。液体状態にある相を液相( liquid phase )という。
液体 ⇒ 固体
液体から固体に変わる現象を凝固( freezing , solidification ),又は固化といい,変化している間は,熱を奪っても温度が一定に保たれ,この温度を凝固点( freezing point )という。通常は融点と同じである。一般的に,水の場合は氷結という。温度変化のみで凝固する場合を特に凍結ともいう。凝固には,融解熱と同じ量の熱エネルギー(凝固熱( heat of solidification ))を放出する。固体状態にある相を固相( solid phase )という。
ページのトップへ
固体・気体間の変化
身近には,固体のドライアイス(二酸化炭素, CO2 )を常温に置いた際に,液体を経ずに直接気体になることを経験できる。このように,固体に熱エネルギーを与えることで,固体を構成する粒子の熱振動が激しくなり,表面近くの一部の粒子が粒子間の引力を振り切り,直接上部の空間に飛び出す(気体に変わる)。逆に,気体から熱を奪うことで固体に直接変化する現象もある。これらの液体を経ずに固体・気体間を直接相転移する現象は,粒子間の引力が小さい物質で起こりやすい。
この現象は,三態の境界線を圧力と温度で示す物質の状態図(相図)において,圧力と温度の交点が三重点より下になった時に起きる。
固体 ⇒ 気体
固体が液体を経ずに気体に変わる現象を昇華( sublimation ),又は気化( vaporization )といい,変化している間は,熱を与えても温度が一定に保たれ,この温度を昇華点( sublimation point )という。昇華のときに吸収するエネルギー(潜熱)を昇華熱( heat of sublimation )という。気体状態にある相を気相( gaseous phase )という。
大気圧でこの現象が観察される物質には,よう素( I2 ,iodine ),ドライアイス(二酸化炭素, CO2 ),防虫剤に用いられるナフタレン( naphthalene,C10H8 )や樟脳(しょうのう,camphor ,C10H16O ),殺虫剤,消臭剤などに用いられるパラジクロロベンゼン( para-dichlorobenzene, C6H4Cl2 )などがある。
なお,水分を含む食品を-30℃程度まで急冷し,減圧乾燥させるフリーズドライ(凍結乾燥,freeze drying )は,氷の昇華現象を利用した技術である。
気体 ⇒ 固体
固体から気体への変化と逆の現象も昇華といわれる。固体からの昇華と区別したい場合には,凝固や凝結と呼ばれることがある。
ページのトップへ
液体・気体間の変化
液体に熱を与えることで,粒子の熱運動が激しくなる。運動エネルギーの大きい粒子が粒子間の引力を振り切り,液体表面(又は界面)から空間に飛び出す(気体に変わる)。
液体の温度が高い場合には,粒子間の引力を振り切れる粒子の数が増え,激しい蒸発が起き,ついに,相図における気相と液相の境界に当たる蒸気圧( vapor pressure )が環境の気圧と等しくなると,液体表面以外に容器壁との界面などからの蒸発(沸騰)に至る。
一方,気体から熱を奪うことで,粒子の運動エネルギーが次第に小さくなり,粒子同士の衝突や液体表面への衝突時に,粒子間の引力に捕えられ液体になる。
圧力が一定の場合に,相転移進行中の温度が一定のままで,熱の放出,又は吸収が見られる。この場合の熱を転移熱( heat of transition ),又は潜熱( latent heat )という。
液体 ⇒ 気体
液体が気体に変わる現象を蒸発( evaporation ),又は気化という。熱を与え続けると,蒸発と共に液体の温度も上昇するが,ある温度に至ると熱を与えても温度の上昇が止まり,容器界面などからも激しく蒸発し始める。この温度を沸点( boiling point )という。蒸発するときに吸収するエネルギーを蒸発熱( heat of evaporation ),又は気化熱( heat of vaporization )という。
気体 ⇒ 液体
気体が液体に変わる現象を凝縮( condensation ),又は液化という。他に,凝結や結露などの用語も用いられる。凝縮する際に放出されるエネルギーを凝縮熱( heat of condensation )という。
ページのトップへ
相図とは
相図( phase diagram )
物質などの相と熱力学的な状態量(温度,圧力など)との関係を表したもので,状態図ともいわれる。相図には,合金や化合物の温度,圧力,組成に関する相図,磁気構造と温度との関係を示す相図など様々ある。
物質の三態と温度,圧力の相図では,液相と固相の境界を融解曲線,気相と固相の境界を昇華圧曲線(昇華曲線),気相と液相の境界を蒸気圧曲線(蒸発曲線)という。
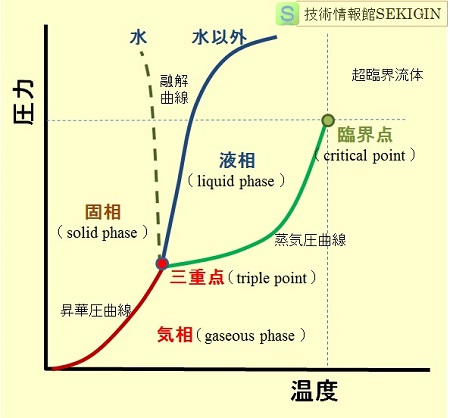
物質の相図(模式図)
一般的に,多くの物質の融解曲線は,圧力の増加と共に固体の融点が高くなる。しかし,水素結合で凝集する水やアンモニアなどの一部の物質の固体は,圧力の増加で融点が低くなるなど特異な現象を示す。【⇒ スケートで良く滑走するのは,スケート刃の圧力で氷が溶け,摩擦力が低下するため。】
ページの先頭へ