第二部:物質の状態と変化 コロイド溶液
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,水を媒質とするコロイドの一種である【疎水コロイドとは】, 【コロイド粒子の帯電】, 【電気二重層】, 【コロイド粒子の安定化】 に項目を分けて紹介する。
疎水コロイドとは
水を分散媒とする場合に,電解質の投入で沈殿(凝析という)しやすいものを疎水コロイド( hydrophobic colloid )という。
103 ~ 109 個の原子の集合体であるコロイド粒子が,水中に分散し安定したコロイド溶液になるためには,いくつかの条件が必要になる。
第一に粒子が分解しないこと
例えば,塩化ナトリウムの微粒子を水中に分散させた場合に,直ちにナトリウムイオンと塩化物イオンに解離し,個々の水和イオンとして水に分散し,電解質溶液になってしまう。従って,コロイド粒子は,水に対して不溶性(又は難溶性)の物質であることが必要となる。
第二に,粒子同士が衝突しても,凝集してさらに大きな粒子にならないこと
すなわち,分子間力で粒子同士が結合しないよう,粒子間に働く適切な斥力が必要である。
疎水コロイドの凝集に抗する粒子間の斥力は,粒子表面の帯電による静電的斥力である。このためこの種のコロイドは,電解質の投入で凝析しやすい。
次には,疎水コロイドの分散の主要因である粒子表面の帯電現象について解説する。
【参考】
帯電( electrification )
物体が電荷を持つこと(帯電する),持たせること(帯電させる),又は持っている状態(帯電している)をいう。なお,帯電したまま動かずにいる電気を静電気という。
クーロン力( Coulomb force )
クーロン力は,静電力,静電気力,静電引力などともいわれる荷電粒子間に働く力。
クーロンの法則( Coulomb’s Low )
フランスの物理学者クーロンが提案した電磁気学の基本法則で,電荷のクーロンの法則と磁荷のクーロンの法則がある。
電荷のクーロンの法則とは,荷電粒子間に働き,反発又は引き合う力(クーロン力)が,それぞれの電荷の積に比例し,距離の 2乗に反比例(逆 2 乗の法則)する。
磁荷のクーロンの法則とは,磁気を帯びた粒子間に働く力に関しても,電荷のクーロンの法則と同様に,距離の逆 2乗の関係がある。
ページのトップへ
コロイド粒子の帯電
分散質/分散媒の界面では,後述の過程を経てイオン(陽イオン,陰イオン)が発生する。発生したイオンの分散質表面への吸着で,粒子の電位が決定する。
分散質表面では,分散質の特性と分散媒の条件( pH ,電解質濃度など)に応じて,特定のイオンが強く吸着(優先吸着)する。この界面電荷を決定するイオンを電位決定イオンと呼ぶ。
例えば,分散媒粒子が難溶性イオン結晶( AB )の場合,僅かであるが粒子界面に A+ ,B- が発生する。分散媒中に他の物質由来の A+ が存在すれば,粒子界面への A+ の吸着が多くなり,粒子は正の電荷を持つ。逆に,B- が多けれは粒子は負の電荷を持つ。
また,分散媒粒子が酸化物や水酸化物の場合は,粒子表面のヒドロキシル基( OH基,水酸基ともいう,吸着した水和水を含む)が,分散媒の pH に応じて電荷を有する。 分散媒の pH が高い場合は,粒子表面の-OH 基が H+ を放出し -O- となり,pH が低い場合には,H+ を取り込み -OH2+ となる。
すなわち,分散媒の pH により粒子界面の電荷は正や負に変わる。粒子界面の電荷が 0 になる pH が存在し,この pH を等電点( iep : iso-electric point ,無電荷点ともいう)という。
例えば, 酸化アルミニウム(α – Al2O3 )の等電点は pH 9.1 ,水酸化鉄 (Ⅱ)( Fe(OH)2 )で pH 12 ,マグネタイト( Fe3O4 )は pH 6.5 などである。
有機系物質でカルボキシル基( -COOH ),フェノール性水酸基( -OH ),アミノ基( -NH2 )のような官能基をもつ粒子では,これらの基が解離し電荷を持つ。
タンパク質のような -COOH と -NH2 の両方を持つ粒子は,等電点を持ち pH が高い場合は負の電荷( -COO- )を,pH が低い場合には正の電荷( -NH3+ )を持つ。
純水中の油滴,気泡のような疎水性物質でも,水の解離で生じた H+, OH- の影響で電荷を持つ。この場合に,H+ が水に対する親和性が大きいため,疎水性物質の粒子は OH- の優先吸着により負の電荷を持つのが一般的である。すなわち,酸化物を除く鉱物性の粒子は,負の電荷をもつことが多いと考えてよい。
ページのトップへ
電気二重層
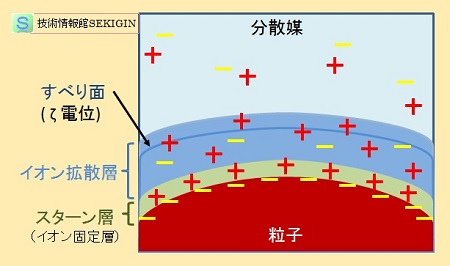
電気二重層(模式図)
【無機塩の水への溶解】で紹介したように,溶媒中のイオンは,その周りを比較的強い力で溶媒分子に取り囲まれ,安定した溶媒和( solvation )の状態で分散している。このため,反対符号のイオンであっても,溶媒和半径以内には互いに近づけない。
しかし,表面に電荷を持つ粒子の場合には,近づいた反対符号のイオン(対イオン)の粒子方向の溶媒分子が外れ,粒子表面に特異的な吸着をしていると考えられている。
図に示すように,特異的なイオン吸着により,溶媒和イオンの半径程度の範囲に硬く結びついた層が存在する。この層をスターン層(イオン固定層ともいう)という。
スターン層の外側には,粒子表面の電荷と静電的な釣り合いを採るため対イオンの豊富なイオン拡散層と呼ばれる層がある。
コロイド溶液に電極を入れ,電界をかけた時,後述の【コロイド溶液の特徴】で紹介する電気泳動いう現象が起きる。電界に従って,コロイド粒子が移動するが,この時に,粒子回りのイオン拡散層には粒子と共に移動するイオンと,周りの溶液に取り残されるイオンとに分かれる。この境界をすべり面と呼び,すべり面の電位をゼータ電位(ζ 電位)という。
【参考】
溶媒和( solvation )
溶液中においてイオン又は溶質分子に溶媒分子が結合する現象。【 JIS K 0211「分析化学用語(基礎部門)」】
溶質分子や電離して生じたイオンが,静電気力や水素結合などの作用で,溶媒分子に取り囲まれ,相互作用しながら拡散する現象である。溶媒が水の場合には,特に水和( hydration )という。
スターン層
電気泳動( electrophoresis )
コロイド溶液に電極を入れて,電圧をかけると,コロイド粒子は表面電荷と反対符号の極へと移動する。この現象を電気泳動という。
この現象は,コロイドの表面の電荷,粒子の大きさ, 形状, 加えた電圧,溶液の pH ,温度などに影響される。すなわち,この現象を利用することで,異なるコロイド粒子を分離・精製できる。
ゼータ電位
ページのトップへ
コロイド粒子の安定化
分散媒表面の電気二重層の存在により,分子間力(ファンデルワールス力)による引力に逆らい,一定の距離を保つことができる。
すなわち,ファンデルワールス力に対して電気二重層による斥力が勝ると,互いの粒子は安定して分散状態を維持できるが,少量の電解質の添加で粒子の電荷が中和され,電気二重層による斥力が劣り,粒子同士はお互いに衝突し凝集する。この現象を凝析(凝結)という。
分子間力は,コロイド粒子固有であるが,静電的反発力は電気二重層の厚さに依存する。電解質添加により,周囲のイオン分布が変化する。すなわち,分散媒中の対イオンが増えることで,コロイド粒子周辺の対イオンが粒子表面方向に押しやられ,電気二重層の厚さが減少する。この結果として,分子間力が強く働く距離まで粒子同士が近づき凝集してしまう。
なお,凝集に必要な塩濃度は,そのイオン価数の 6 乗に反比例(シュルツ・ハーディの法則)する。
同様の現象は,加熱によっても起きる。すなわち,加熱により粒子の熱運動が増大することで,衝突時の粒子間の距離が小さくなり,分子間力が強く作用し凝集する。
【参考】
シュルツ・ハーディの法則( Schulze-Hardy rule )
負に帯電する疎水コロイドの凝析における凝析価と添加した電解質の陽イオン価数との関係に関する経験則である。
「コロイド帯電電荷と反対電荷を持つ電解質の添加によりコロイドは沈殿するが,この時の凝析価は一価の陽イオンを基準にして,イオン価数の6乗に反比例する」
凝析価( coagulation value,flocculation value )
コロイド溶液を一定時間内に凝結させる添加物質の最小濃度を,その物質のそのコロイド溶液に対する凝析価という。凝結価ともいわれる。
ページの先頭へ