第二部:物質の状態と変化 気体の状態方程式
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
気体の弾性,圧縮や拡散などの現象は,17 世紀の科学者たち(ボイル,シャルル,ゲイリュサック,ドルトン,グレアムなど)の興味の的で,この時期に気体の性質に関する一般的な法則が数多く導き出された。
ここでは,基本法則として,【ボイルの法則】, 【シャルルの法則】, 【ゲイ=リュサックの法則】, 【ボイル・シャルルの法則】 に項目を分けて紹介する。
ボイルの法則
ボイルの法則( Boyle's law )
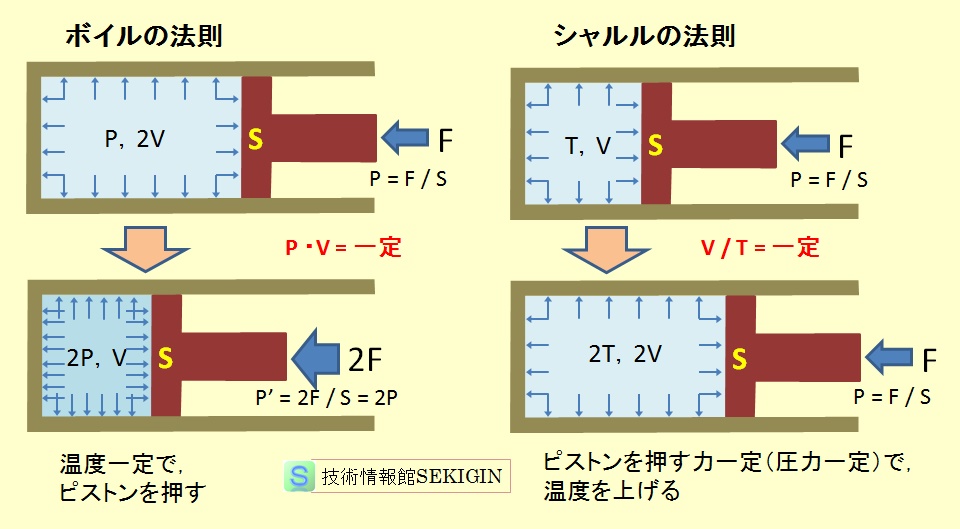
ボイルが 1662年に提案した「一定温度で,一定量の気体の体積 V は圧力 P に反比例する。」をいう。
すなわち,一定の気体をピストンのついた容器の中に詰め,ピストンを外から押して動かないようにした時に,外気圧を含めたピストンに加えている力は,中の気体の圧力×ピストンの面積に等しい。
ここで,温度一定のままで,ピストンを動かし,体積を 1/2まで圧縮すると,ピストンを抑えるのに必要な力は,最初の 2倍になる。
この関係を式で表すと,
PV = C(一定)
となる。なお,C は温度が変わらなければ一定の比例定数である。
【参考】
ボイル( ロバート・ボイル;Robert Boyle )
ボイル( 1627年~ 1691年)はアイルランドの錬金術師,自然哲学者,化学者,物理学者,発明家で神学に関する著書もある。
ボイルの法則とシャルルの法則のイメージ図
ページのトップへ
シャルルの法則
シャルルの法則( Charles's law )
1778年にシャルルが提案した「圧力が一定のとき,理想気体の体積は熱力学的温度に比例する。」をいう。
すなわち,一定の気体をピストンのついた容器の中に詰め,容器の中に入れた気体の温度を高くすると,気体分子の熱運動が盛んになる。ピストンを自由に動けるようにしておくと,気体の圧力が変わらず体積が増加する。
この方法で,温度変化による体積の増減を測定すると,温度の変化に対し体積が直線的に変化する。 0℃の体積を V0 とすると,その勾配は気体の分子種によらず, V0 / 273.15 である。
すなわち,体積 V の温度 t(℃)との関係は,
V = ( V0 / 273.15 ) ×t+ V0 = ( V0 / 273.15 ) × ( t +273.15 )
となる。
ここで,( V0 / 273.15 ) は,圧力が決まれば一定値になるので,定数 C とできる。セルシウス温度(℃)を含む項 ( t +273.15 ) は,熱力学的温度 T(絶対温度 K :ケルビン)となるので,上の式は,
V = C・T ,∴ V / T = C(一定)
と単純化できる。
式からは,0 K で体積 0 となるが,実際には有限の体積を保持するので,厳密にはシャルルの法則は理想気体に対して成立する関係である。
【参考】
シャルル( ジャック・アレクサンドル・セザール・シャルル; Jacques Alexandre César Charles )
シャルル( 1746 ~ 1823年)は,1783年 12月 1日にロベール兄弟と共にパリのテュイルリー宮殿で有人気球(水素)の初飛行を行ったフランスの発明家(物理学者,数学者,気球乗り)である。
1787年ごろに行ったシャルルの実験(5つの風船に異なる気体を詰め,温度を上げて体積の比較)で,いずれの風船も同じ大きさまで膨張することを発見したが,これは未発表であった。
1802年にジョセフ・ルイ・ゲイ‐リュサックが1802年の論文でこの実験に言及し,気体における体積と温度の関係を「シャルルの法則」と冠した。
ページのトップへ
ゲイ=リュサックの法則
ゲイ=リュサックの法則( Gay-Lussac's law )
フランスの化学者ジョセフ・ルイ・ゲイ=リュサックに因んで命名された 2 つの法則である。一般的に,単にゲイ=リュサックの法則という場合は,第 1 の法則「気体反応の法則」を指し,第 2 の法則はアモントンの法則と呼ばれる。
第 1 の法則
この法則は,1808 年に公表され,気体反応の法則とも呼ばれる。気体が反応して別の気体を生成し,全ての体積を同じ温度で測定した時,「反応物と生成物の気体の体積の間の比は,簡単な整数の比で表される」。
第 2 の法則
この法則は,1802 年に公表しているが,1700年から1702年にかけて一定質量のガスの質量を保って圧力と温度の間の関係を発見したギヨーム・アモントンに因んで,アモントンの法則とも呼ばれる「一定の質量と一定の体積の気体の圧力は,気体の熱力学的温度に比例する」である。式で示すと,P / T = C(一定)となる。
【参考】
ジョセフ・ルイ・ゲイ=リュサック( Joseph Louis Gay-Lussac )
フランスの化学者,物理学者( 1778~ 1850年 )で,シャルルの法則の発見者の一人である。アルコールと水の混合について研究し,アルコール度数を「ゲイ=リュサック度数」と呼ぶ国も多い。
ページのトップへ
ボイル・シャルルの法則
ボイル・シャルルの法則( combined gas law )
前出のボイルの法則,シャルルの法則及びアモントンの法則(ゲイリュサックの第 2 の法則)をまとめ,気体の性質に関し,理想気体の体積( V ),圧力( P ),熱力学的温度( T )に関係を統括的に説明する法則「気体の圧力 P は体積 V に反比例し,熱力学的温度 T に比例する」である。
ボイル・シャルルの法則は,ボイルの法則: PV = 一定,シャルルの法則: V / T = 一定,アモントンの法則: P / T = 一定,から導かれる気体に関する一般則である。式で示すと次のようになる。
PV / T = C(一定)

ボイルの法則とシャルルの法則のイメージ図
ページの先頭へ