第二部:物質の状態と変化 希釈溶液の性質
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,理想溶液に準じる理想希薄溶液の束一的性質として知られる浸透現象について,【浸透圧とは】, 【浸透圧の熱力学的扱い】, 【浸透圧に関するファントホッフの法則】, 【参考:束一的性質をもいた分子量の求め方】 に項目を分けて紹介する。
浸透圧とは
ここでいう浸透(しんとう)とは,液体を隔てる膜の小さな穴を液体がすり抜け浸み出すことをいう。
溶媒分子は透過できるが溶質分子が透過できない半透膜( semipermeable membrane )を介して,溶質の濃度が高い溶液と濃度の低い溶液(又は純溶媒)とが隔てられている場合には,溶媒分子が溶質濃度の高い溶液側へと自然に移動し,溶質の濃度差を解消(エネルギー差の解消)しようとする。この時に発生する圧力を浸透圧( osmotic pressure )という。
浸透圧現象と測定法
浸透圧の解説で良く用いられる模式図を下に示した。この図では,溶媒の分子が濃度の高い溶液側に移動することで,溶媒側の液面が低下し,溶液側の液面が上昇する。
溶液の液面上昇は,すなわち溶液濃度の低下になる。溶媒と溶液の液面高さの差(圧力差)が大きくなるとともに,溶液の濃度が低下する。
ついには,溶液の濃度低下とともに,液面の高さに相当する圧力差により,半透膜を介した溶媒分子の移動が釣り合った段階で,液面の変動が停止する。
この時の圧力差は,溶媒分子の移動で低下した濃度における溶液の浸透圧であり,最初の溶液濃度の浸透圧とは異なる。
最初の溶液濃度の浸透圧を求めようとすると,半透膜を挟んで液面の高さが変わらないように,溶液側に圧力を加え,溶媒側の圧力(大気圧など)との差圧を計測しなければならない。
浸透圧は,希薄溶液中では,物質の種類に依存しない法則が成立するという束一的性質( colligative properties )の一種である。
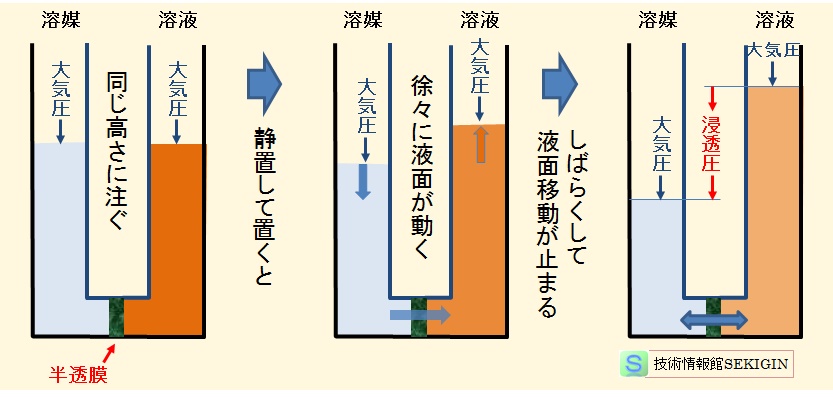
浸透圧現象の説明で良く用いられる模式図
【参考】
半透膜( semipermeable membrane )
粒子(分子やイオン)の大きさで,物質を分別できる膜である。適切な半透膜を用いると,溶液のモル濃度と浸透圧が比例するので,高分子化合物などの分子量を測定できる。
実用の膜には,フェロシアン化銅の沈殿膜,コロジオン膜,膀胱膜,多孔質高分子膜などがある。多孔質高分子膜の原材料には,セロファン,アセチルセルロース,ポリアクリロニトリル,テフロン,ポリエステル系ポリマーアロイ,ポリスルホンなどが用いられる。
半透膜を介して移動する物質に対し溶媒と溶質の何れかに注目するかで,溶媒の移動に注目する浸透(しんとう: osmosis )と,溶質の分別に注目する透析(とうせき: dialysis )とに現象に対する呼称が変わる。
例えば,血液中の老廃物である生体高分子や塩を透析により分離し,血液を正常化する透析療法(人工透析),浸透圧以上の圧力を掛け,半透膜を通らない溶質の濃縮(逆浸透:海水の淡水化など)に利用されている。
半透膜の穴(空隙)のサイズは,対象とする粒子の大きさで決まる。この場合に,粒子の大きさは溶媒和の程度とその大きさを考慮しなければならない。
浄水の製造で微粒子除去目的に用いる限外ろ過膜( Ultrafiltration Membrane )は,概ね 1 ~ 10 nm の孔径を持ち,イオンの除去を目的で用いる逆浸透膜( RO 膜: Reverse Osmosis Membrane )は 2 nm 以下の孔径を持つ。
ページのトップへ
浸透圧の熱力学的扱い
溶媒分子は半透膜を透過して溶液側に出入りできる。すなわち,温度 T の平衡状態では,純溶媒の圧力 P より浸透圧(Π:パイ)だけ高い圧力( P+Π )の溶液の溶媒の化学ポテンシャル( μA )と圧力 P の純溶媒の化学ポテンシャル( μ0A )が等しくなければならない。希薄溶液の溶質のモル分率をχとすると平衡状態では,
μA( T , P + Π , χ ) = μ0A( T , P )
が成り立つ。溶液が理想希薄溶液の場合には,溶液中の溶媒の化学ポテンシャルは,溶媒のモル分率 χA を用いて
μA( T , P + Π , χ ) = μ0A( T , P + Π ) + RT ln χA
で与えられる。ここで,沸点上昇で解説した方法と同様に,テーラー展開し,ν =(∂μ/∂P)T の関係を用いると,
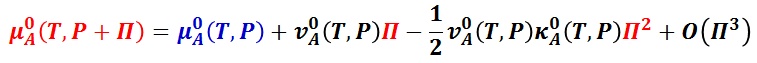
が得られる。ここで,ν0A (T, P) は純溶媒のモル体積で,Κ0A (T, P) は純溶媒の等温圧縮率である。 なお,O(Π3 )は,テーラー展開の三回微分以降の項をまとめて示したものである。
多くの場合では,常温常圧では液体の等温圧縮率が小さく,浸透圧 Π の 2次以上の補正項は無視しても差し支えない。従って,
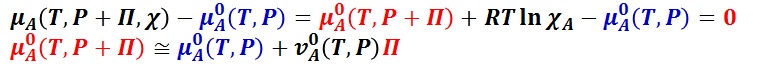
とできる。ここで,沸点上昇で説明したように,溶質の総和が極めて低い理想希薄溶液では,溶媒のモル分率を溶質のモル分率で近似できるので,浸透圧 Π は,
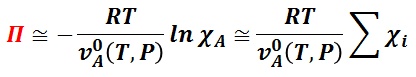
と近似できる。この式から,理想希薄溶液の浸透圧 Π は溶質のモル分率の総和と温度に比例し,純溶媒のモル体積に反比例する。これは,次に紹介するファントホッフの法則でもある。
ページのトップへ
浸透圧に関するファントホッフの法則
オランダの化学者,ヤコブス・ヘンリクス・ファント・ホッフ( 1852 ~ 1911 年)が 1887 年に,「浸透圧は,熱力学的温度と溶液のモル濃度に比例する」,即ち浸透圧(Π:パイ)が理想気体の状態方程式と同じく扱えることを証明した。
ファント・ホッフは,ドイツのベッファーが 1874 年に行ったスクロース溶液(ショ糖溶液)の浸透圧と温度や濃度の関係を求める実験で得られた実験式(Π = kc T : k は比例定数,c はモル濃度 mol / L ,T は熱力学的温度 K )を詳細に検討し,浸透圧も理想気体の状態方程式と同様の
Π V = n R T
ここで,V :体積( m3 ),n :物質量( mol ),
R :気体定数(≒ 8.314 J K-1 mol-1),T :熱力学的温度( K )
で表せることを証明した。
参考:単位の換算 J = N m ,Pa = N m-2 ,∴ R ≒ 8.314 J K-1 mol-1 = 8.314 Pa m3 K-1 mol-1
溶質が電解質の場合は,沸点上昇,凝固点降下と同様に,モル濃度 c ( = n /V ) については,【沸点上昇】で紹介したファントホッフの因子を導入した補正が必要である。
ページのトップへ
参考:束一的性質を用いた分子量の求め方
束一的性質と分子量
沸点上昇,凝固点降下,及び浸透圧は,希薄溶液中では,物質の種類に依存しない法則が成立するという束一的性質を示す。従って,これらの測定により,実験的に溶質の分子量を測定できることが分かる。
沸点上昇,凝固点降下と分子量
沸点上昇:⊿ T ≒ Kb m,凝固点降下:⊿ T ≒ Kf m ,ここに, Kb :モル沸点上昇, Kf :モル凝固点降下である。
溶質の質量モル濃度 m ( mol / kg )は,溶質のモル質量 M ( g / mol ),溶質の質量 w( g ),溶媒の質量 W ( g )とすると,m = 1000 w / ( W・M ) とできるので,溶質に単一物質を用いることで,モル質量(分子量) M は次式で求められる。
M = 1000 K w / ( ⊿T W )
浸透圧と分子量
浸透圧:Π = n R T / V,ここに,n :物質量( mol ),R :気体定数,T :熱力学的温度( K ),V :体積である。
物質量 n は,溶質の質量 w( g )を溶質のモル質量 M( g / mol )で割ったものであるから,溶質に単一物質を用いることで,モル質量(分子量) M は次式で求められる。
M = m R T / ( Π V )
ページの先頭へ