第二部:物質の状態と変化 希釈溶液の性質
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,最も身近で,溶媒としても広く用いられる水について,【水の光学特性】, 【水を基準にした単位の歴史】, 【水の基本特性】 に項目を分けて紹介する。
水の光学特性
水の色
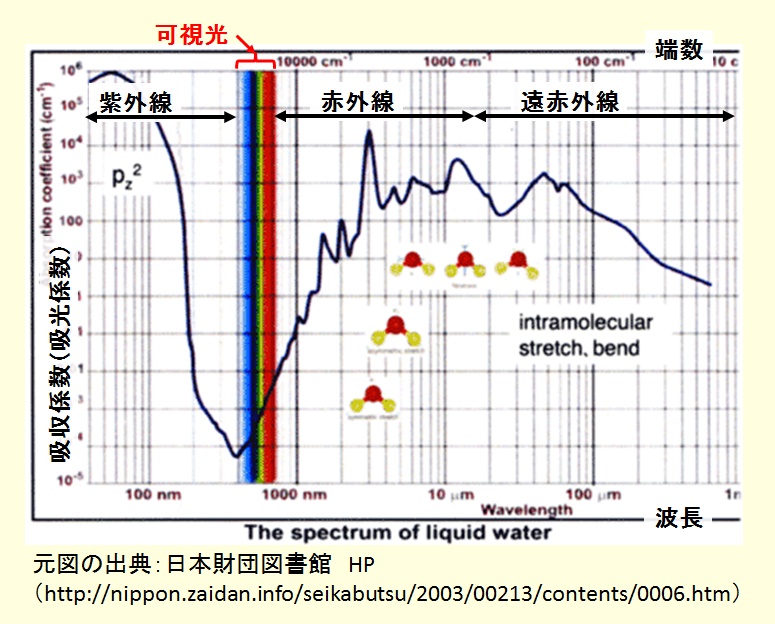
水の吸収スペクトルの例を下図に示す。光の波長(又は波数)を横軸に,光の吸収係数( absorption coefficient )を縦軸に示したものである。
なお,波数とは 1cm 当たりの光の波の数,即ち波長の逆数であり,赤外線吸収スペクトルなどでは,波長より波数で表示するのが一般的である。
媒質に入射する前の光の強度をⅠ’としたとき,媒質中の距離 X 通過した後の光の強度 Ⅰ は,ランバート(ランベルト)・ベールの法則( Lambert-Beer's law )に従い次式で示される。
Ⅰ = Ⅰ’e-αX =Ⅰ’10-βX
ここで,α又はβを吸収係数という。
図から分かるように,吸収係数は,光の波長により異なり,可視光領域の吸収係数は,紫外線から青色領域の波長で小さく,赤色から赤外線領域の長い波長領域では大きい。
このことは,太陽光などが水を透過した場合に,青色に比較して赤色の光の吸収が多いため,無色透明ではなく,僅かに青緑色を呈することを表している。
なお,海の色や湖で観察される色は,溶解した成分や不純物の影響を強く受けているので水の本来の色とは異なるが,【凝固点降下】の項で紹介したように,海が冷えてできた海氷(流氷など)は,氷の成長段階では,基本的に塩分を含まない氷ができる。TVニュースなどで見られる流氷の映像で,僅かに青みを帯びているのは,水の本来の色に近いと考えられる。。
水の吸収スペクトル(吸収係数 VS 波長)
ページのトップへ
水を基準にした単位の歴史
水は最も身近な物質の一つで,取扱が容易なため,化学・物理の発展において,単位の基準として重要な役割を演じていた。
質量( mass )
1790年にフランス革命初期に成立した国民議会において「自然の標準に準拠し,永遠に世界で用いられる新単位系」の創造への着手を宣言したのが始まりであった。パリ科学学士院の委員会が,新単位系の基礎として地球子午線長の 4分の 1 をとり,その実測を行うこと,および 0℃における既知体積の蒸留水の質量の測定を行うことなどを決定した。
1799年には,メートル原器と同時に白金製のキログラム原器が作製された。質量は,標準気圧のもとで最大密度をもつ約 4℃(厳密には,3.98 ℃)の純粋の水 1dm3 (立方デシメートル)の質量を 1kg と定めた。このときの体積を特に 1L(リットル)と定めた。
長さの単位と同様に,人工物のキログラム原器の利用の限界が議論されている。これに変わる基準は定められていないが,2011年にプランク定数に基づく定義に移行することが国際的に合意され,世界各国の研究所において,プランク定数を基準とした質量の表現について研究が進んでいる。
体積( volume )
1799年には,メートル原器と同時に白金製のキログラム原器が作製された。質量は,標準気圧のもとで最大密度をもつ約 4℃の純粋の水 1dm3 の質量を 1kg と定めた。このときの体積を特に 1L(リットル)と定めた。
1901年の国際度量衡総会で「 1L は,1気圧のもとで最大密度にある純粋な水 1kg の占める体積」と定められ,この定義は長い間使われた。
1950年に,キログラム原器の質量を 1kg として,最大密度の純水の体積を精密測定した結果,1L = 1.000028 dm3 と改定された。
1964年には,メートル法による体積表示との混乱を避けるため,純水の質量とは無関係に, 1L(リットル)は 1dm3 の別称とすると再改定された。
温度(temperature)
温度を定量的に定める試みの初めは,ガリレオ・ガリレイ(1564~1642年)による空気の熱膨張を利用し温度を求めようとした空気温度計といわれている。
18 世紀になり,透明容器に水銀やアルコールを封入し 実用性の高い液体温度計(liquid thermometer)が開発された。
その後,種々の温度計が発明され,それぞれの温度計ごとに適宜分割された目盛で温度が表示されていた。このため,異なる温度計で得た値が比較できない状況であった。そこで,基準となる点を定めた温度目盛りが採用されるようになった。
1724年に,ドイツの物理学者ファーレンハイト(1686 ~ 1736年)が,塩と氷の寒剤の温度を 0 度,(体温を 100 度),水の沸点を 212 度としたファーレンハイト温度目盛(ファーレンハイト度,カ氏,degree Fahrenheit,記号 ℉ )を提唱した。
1742年に,スウェーデン天文学者のセルシウス(1701年 ~ 1744年)が,大気圧( 1 気圧)における水の凝固点を 100 度,沸点を 0 度としたセルシウス温度目盛を提唱した。
このように,当初は,温度が上がると表示値が下がる目盛であったが,セルシウスの死後(1744年)に,水の凝固点(水の三重点)を 0 度,沸点を 100 度とする現在のセルシウス温度目盛(セルシウス度,セ氏,degree Celsius,記号 ℃ )に改められた。
カルノーサイクルの研究を進めることで,トムソン(ケルビン卿:1824年~1907年)が,1848年に熱力学的に温度目盛りが定められることを示し,熱力学的な絶対温度(absolute temperature)を提案した。
1954 年の第 10 回国際度量衡総会において,唯一の温度の定点として水の三重点の温度を 273.16 Kと定め,国際単位系 SIの基本単位として温度の単位ケルビン(記号 K )を水の熱力学(的)温度の 1/273.16 とすることが決定された。なお,水の三重点のセ氏温度は 0.01℃であるから,同一温度の絶対温度 T とセ氏温度 t との関係は T = t+273.15 で与えられる。
近年は,絶対温度の呼称より,熱力学(的)温度(thermodynamic temperature),ケルビン温度の呼称が広く用いられる。
熱量( quantity of heat )
熱量とは,物体間を移動する熱,発熱化学反応で発生する熱,吸熱化学反応で吸収される熱などの大きさを熱量という。熱はエネルギーの一種であり,SI単位のジュール( J )を用いることが推奨されているが,熱にだけ用いられる特有の単位として,カロリー( cal )も,いまだに慣例的に用いられ続けている。
1824年に,フランスの物理学者ニコラス・クレマンが蒸気機関の熱効率を測定するのに便利なように「水 1 kg の温度を 1 ℃ 上げるのに必要な熱量」を Calorie と名付けた。
1852年に,熱化学の分野で「水 1 g の温度を 1 ℃ 上げるのに必要な熱量」を calorie と定義した研究が発表されることで,化学分野でこの定義の使用が進んだ。英国学術協会は,この定義を採用し,1896年に単位名を calorie とした。
このように,熱量を表す単位には,頭文字が大文字の Calorie と記する kg-calorie(キログラムカロリー,大カロリー)と小文字で始まる calorie と記する g-calorie(グラムカロリー,小カロリー)の2種類が混在していた。
現在の日本では,計量法により,熱量の単位には SI単位の J(ジュール)を用いることが推奨されている。なお,栄養学の分野のみで,慣例に従い,cal(= 4.184 J )の使用が認められている。
【参考】
長さ( length )
1790年にフランス革命初期に成立した国民議会において「自然の標準に準拠し,永遠に世界で用いられる新単位系」の創造への着手を宣言したのが始まりであった。
その後,7年の歳月を費やし,パリを通る地球子午線に沿って,ダンケルクとバルセロナ間を実測し,パリを通る子午線の 1象限(北極から赤道まで)の 1000万分の 1の長さを 1mと定め,1799年に白金製の最初のメートル原器(アルシーブ原器)が作られた。
1869年には,アルシーブ原器に合わせて作製された白金とイリジウムの合金製の新原器が各国に配られた。日本国メートル原器は No.22と呼ばれ,産業技術総合研究所計量標準総合センターに保管されている。
その後,人工物の原器を使い続けることの限界が明白になってきたため,1960年に,クリプトン( Cr )原子が出す橙色の光が真空中を進むときの波長の 1 650 763.73倍を 1m とすると定義された。
参考文献:小泉 袈裟勝,「国際単位系(SI)への道」,電気学会誌 1994年 114巻 9号 p.582-587
ページのトップへ
水(氷)の基本特性
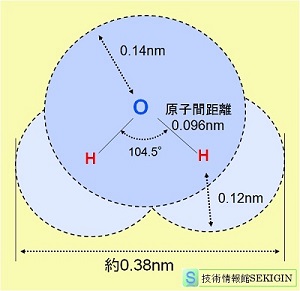
化学式( H2O ),モル質量( 18.0153 g / mol ),分子の形( 曲線状),双極子モーメント( 1.85 D )
融点( 0 ℃,273.15 K ), 沸点( 100 ℃,373.15 K )
密度( 999.972 kg m−3 液体 (4 °C),916.8 kg m−3 固体 ( 0 ℃) ),粘度( 0.001 Pa s ,20 ℃)
水分子の構造
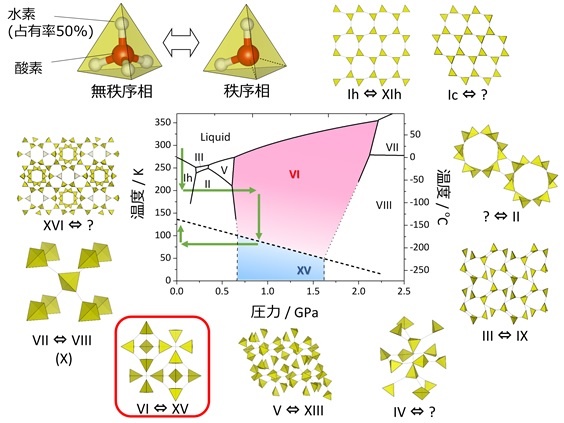
水の結晶である氷は,大気圧では透明な六方晶系の結晶である。圧力が非常に高い状態では複数の構造を持つ。大気圧から比較的高い圧力(数千気圧)までは,最も身近な構造の氷(氷Ⅰ)であるが,さらに圧力が高くなると,氷の構造が変わり,現在までに氷Ⅱから氷ⅩⅤまで発見されている。きわめて高い圧力下では,水素結合が縮んで水分子の配列が変わためのと考えられている。
大気圧付近で凍った氷の体積は,水の体積から約 10 %増加するため,比重が0.9168 と小さくなり,水に浮くことができる。
氷の相図と結晶構造
出典:J-PARCセンター,
高圧氷に新たな秩序状態を発見~ 氷の五大未解決問題の一つを解決 ~
● 液体の水( H2O )の構造
周期表第 16族の酸素( O )の水素化物である水は,2 つの共有電子対と 2 つの非共有電子対を持つ。
水素と酸素の電気陰性度の差が比較的大きく,非対称の分子構造のため,双極子が発生する。すなわち,2つの水素原子が正の電荷を持ち,2つの非共有電子対が負の電荷を持つ。
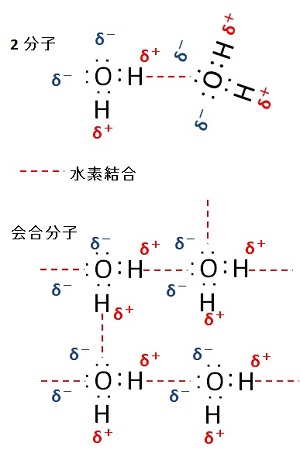
2分子会合した状態では,電荷のバランスを取るように,一つの水素原子を介して近接する。
複数の水分子が会合した場合には,下図に示すように,2つの水素原子と 2つの非共有電子対の間で,複数の水素結合を形成でき,3次元的な広がりを持つように会合できる。
液体状態の水では,図にあるように,水素結合に預からない水素原子と非共有結合が少なからず存在し,自由に回転・移動ができる水分子の集団を形成する。
液状の水の温度低下で複数の水素結合が容易になり水分子の会合が進むとともに,水分子の熱運動量も減る。この結果として,液状の水の体積が減少する。
しかしながら,約 4℃で液体の体積が最小になり,さらに温度が低下すると,液体の体積が増加する。この現象は,温度低下により,水素結合が進み,水分子の自由な回転・移動が制約され,3次元的な水素結合による正四面体状のすき間の多い構造が多く占めるようになるためと考えられる。
すなわち,4℃以下の水では,凝固後を含めて温度低下により体積増加(密度の減少)といった特有の現象を示す。
水分子の会合
ページの先頭へ