第二部:物質の状態と変化 希釈溶液の性質
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,溶媒としての水の特異性の原因について,【液相の水の構造】, 【水素結合の影響】, 【水クラスター】, 【水の自己解離】 に項目を分けて紹介する。
液相の水の構造
水は,分子量 18 と小さいにもかかわらず,前項で紹介したように,高い融点,沸点,特異な性質を示す要因としては,水の分子構造と分子間のに作用する水素結合,水分子の自己解離と考えられている。
水素結合の原因や特徴については,【水素結合の影響】 ,【水素結合と分子の凝集】で説明している。
水の構造の変遷
レントゲンは,水が 4℃で最も密度が大きくなる理由を説明するために,1892年に「水は氷によく似た構造と未知の構造との 2つが混ざってできている」という「ミクロ不均一モデル」を提唱した。
1912年にドイツのマックス・フォン・ラウエにより X線回折現象が発見され,結晶構造の研究が飛躍的に進んだ。1933年には,水の X線回折データから「水は正四面体の各頂点とその中心に H2O 分子が配された氷の構造が連続的にゆがんでできている」という「連続体モデル」が提唱された。
その後の様々な分光学的解析や,1980年以降急速に高性能化したコンピュータによる 3次元分子動力学シミュレーションの結果を経ても,「ミクロ不均一モデル」を支持する検証可能な直接的証拠が得られなかったため,長い間「連続体モデル」を支持する研究者が多かった。
しかしながら,2008年に理化学研究所のチームが,大型放射光施設( SPring-8 ),米国 SSRL( Stanford Synchrotron Radiation Lightsource )の 2つの放射光施設を利用した軟 X線発光分光(SXES:Soft X-ray Emission Spectroscopy または XES:X-ray Emission Spectroscopy)で液体の水の中に少なくとも 2種類のはっきりと異なる微細構造が存在文献 1)することを明らかにした。
次いで,X線小角散乱(SAXS:Small Angle X-ray Scattering),X線ラマン散乱(XRS:X-ray Raman Scattering)などから得られた結果を踏まえて,「ミクロ不均一モデル」を支持する状態にあることを発見文献 2)した。
測定データの解析を進め,2013年には,氷によく似た構造と水素結合に欠損のある構造の 2種類の成分からなる秩序構造が水の中に存在しているという仮説文献 3)を提唱しいる。
2020年には田中 肇,シー・ルイが,最新のコンピュータによる 3次元分子動力学シミュレーションとX線散乱実験データの詳細な解析を行い,水の構造因子には見かけ上の「一つ目の回折ピーク」の中に 2つのピークが隠れていることを発見した。
隠れたピークの 1つは水の中に形成される正四面体構造に関連した密度波に起因したピークで,もう 1つのピークはより乱れた構造に関係した密度波から生じていることを発見文献 4)した。
この結果は,水の構造が,熱揺らぎの下で「規則的な構造と乱れた構造といった 2種類の構造の動的な混合物であり,その結果 2つの構造の存在を反映して 2つのピークを持った分布を示す」という「ミクロ不均一モデル」に有利な実験的に検証可能な水の構造の特徴に関する直接的証拠が得られたといえる。
水が 2つの状態の共存状態であることは,他の液体に見られない温度・圧力・イオン濃度などにより 2つの状態の分率が変化し,水の状態の大きな変化の原因になりうると考えられる。
文献 1 ) T.Tokushima, Y.Harada, O.Takahashi, Y.Senba, H.Ohashi, L.G.M.Pettersson, A.Nilsson, S.Shin " High resolution X-ray emission spectroscopy of liquid water: The observation of two structural motifs." Chemical Physics Letters Volume 460, Issues 4–6, 30 July 2008, Pages 387-400
文献 2 ) 「均一と考えられていた液体の水に不均一な微細構造を発見 -透明な水に隠された謎を日米の放射光の観察で解明- 」 理化学研究所 研究成果(プレスリリース)2009 2009年8月11日
文献 3 ) Yoshihisa Harada, Takashi Tokushima, Yuka Horikawa, Osamu Takahashi, Hideharu Niwa, Masaki Kobayashi, Masaharu Oshima, Yasunori Senba, Haruhiko Ohashi, Kjartan Thor Wikfeldt, Anders Nilsson, Lars G. M. Pettersson, and Shik Shin " Selective Probing of the OH or OD Stretch Vibration in Liquid Water Using Resonant Inelastic Soft-X-Ray Scattering " Phys. Rev. Lett. 111, 193001 – Published 8 November 2013
文献 4 ) Shi, R., Tanaka, H. " Direct Evidence in the Scattering Function for the Coexistence of Two Types of Local Structures in Liquid Water." J. Am. Chem. Soc. 2020, 142, 6, 2868–2875
ページのトップへ
水素結合の影響
水は化学式 H2O で表されるように,酸素原子( O )と水素原子( H )が共有結合( covalent bond )で結びついた化合物である。その結合では,水素原子と酸素原子から価電子を 1つずつ供給された電子対を共有している。酸素原子は,さらに共有結合に使われていない 2 つの孤立電子対が最外殻に存在する。
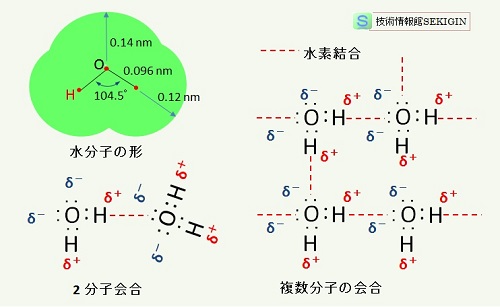
水分子の形と水素結合の模式図
このように,水分子の特異な構造のため,水の比誘電率は 79.87 (20℃) と高い。このため水に触れたイオン結晶では,イオン間の静電気力が弱められ,ついには,イオン結晶の結合格子を破壊して溶解できるほどの能力を持つ。
複数の水分子の間では水素原子と酸素原子の間に水素結合を作ることができる(水クラスター)。この水素結合は,水分子どうしに限らず,最外殻に孤立電子対を持つ窒素,酸素やフッ素などの原子やイオン,あるいは他の電気陰性度の高い原子に結合している水素原子を介して,水素結合を作ることができる。
従って水は,イオン性の低い分子の固体(又は液体)に対しても,分子中の電気陰性度の違いが大きい原子との強い分子間力で結びつき(水和),固体(又は液体)中の分子間力(ファンデルワールス力)に抗して個々の分子に分散できるため,高い溶解性を示す。
一方,シクロヘキサンなどのイオン性が無く,電気陰性度の大きい原子を持たない炭化水素化合物に対しては,水分子との分子間力はファンデルワールス力のみであるため,分子レベルでの分散には至らないので溶解性は極めて小さくなる。
ページのトップへ
水クラスター
クラスターとは,葡萄の房,集団や群れを意味し,水クラスター( water cluster )とは,液体の中で複数の水分子が会合し,一団となっている様子を指す。
水溶液中での水クラスターについて分かっていることはとても少なく,化学上の未解決問題のひとつである。
現時点では,水分子がそれぞれランダムに存在するより,水クラスターを形成することで密度と温度の関係など,水の特異な性質を説明し易いとされている。
理解されていないことの多い水クラスターではあるが,実験化学的アプローチ,計算化学的アプローチにより明らかにされつつある。
次には,インターネット等で紹介されている情報を紹介するが,その真偽については確認していない。
水クラスターの構造については,分光学的性質の測定で,水の六量体( 6 個の水分子クラスター),赤外分光法と質量分析計を直結させた装置による測定で八量体から十量体までの水クラスターが観測されている。
計算化学による検討で,液相では八量体クラスターが優位で,五量体と六量体がそれに続くこと,サイズの小さい溶質を取り込めるような空間を持つ環状の六量体や五量体から成ること,立方体型の八量体と二種類の環状四量体との平衡が存在することなどを提案している。しかしいずれのモデルも,水の特異性,例えば密度の変化を十分には説明できていない。
水クラスターの動的性質については,水クラスターの寿命は極めて短く,絶えずクラスター構造を変えていること,時間分解能の高い赤外分光法の解析で,5 × 10-14 秒以内に緩和され消失すること,その他の測定でも 10-14 秒から 10-12 秒オーダーの時間での動的変化を観測したとの報告がある。
ページのトップへ
水の自己解離
水分子は水素イオン( H+ :プロトン)の供給源(酸)としての性質を示す。水分子の酸素原子上には,孤立電子対があり塩基,配位子としても働く。水分子を配位子とする錯体は水和物となる。
酸と塩基の定義のうち,【配位結合】で紹介したアレニウス酸・塩基の定義は水溶液中を前提にしたものである。
プロトンの供与,及び受容の両方を行うことのできる溶媒中では,一部の溶媒が溶媒同士でプロトンを授受しイオン化する。この平衡を溶媒の自己解離( Self-ionization )と呼ぶ。
水の自己解離: 2 H2O ⇆ H3O+ + OH−
従来は,H2O ⇆ H+ + OH− と表記していたが,実際には遊離のプロトン( H+ )として存在せず,常に溶媒和したヒドロニウムイオン( H3O+ )として存在するので,最近の表記は上記に変わっている。
なお,一般的にはプロトンを受容した溶媒陽イオンをリオニウム( lyonium ),プロトンを供与した溶媒陰イオンをリエイト( lyate )と呼ぶ
自己解離は,平衡反応である。生成したリオニウムとリエイトの濃度の積は,温度と圧力に依存する一定の値である。これを自己解離定数,又はイオン積と呼び Kapで表す。
水の場合は KWで表し,KW = [H3O+]・[OH−],25 ℃で約 10−14 である。
なお,一般的には,対数をとり符号を変えた pKW (= − log KW )= 14 を自己解離定数またはイオン積と呼ぶこともある。
ページの先頭へ