第一部:化学と物質構造・共有結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,共有結合について,【電子対の共有】, 【基礎用語】 に項目を分けて紹介する。
電子対の共有
複数の原子が結合することで,電子軌道( electron orbital )は原子軌道から分子軌道( molecular orbital )に遷移する。
ここでは,2個の水素原子( H )が結合して水素分子( H2 )になる過程を例に解説する。
気体状態で自由に飛び回る水素原子が,何らかのタイミングで衝突するとき,2つの水素原子間の距離とエネルギー変化は,下図のように考えられる。
曝された環境の熱で自由に運動(熱運動)している 2個の水素原子が,ある距離まで接近すると弱い引力(ファンデルワールス力; Van der Waals force )が働く。
さらに接近すると,互いの電子雲が重複するようになり,原子核の正の電荷と相手方の電子雲の負の電荷に静電的引力(クーロン力; Coulomb force )が働く。
この段階で,それまでの球状の電子分布から電子雲の重なりによる分布の歪み(電子同志の反発)が生じ,それぞれの原子が持つ電子の間に相互作用が働く。
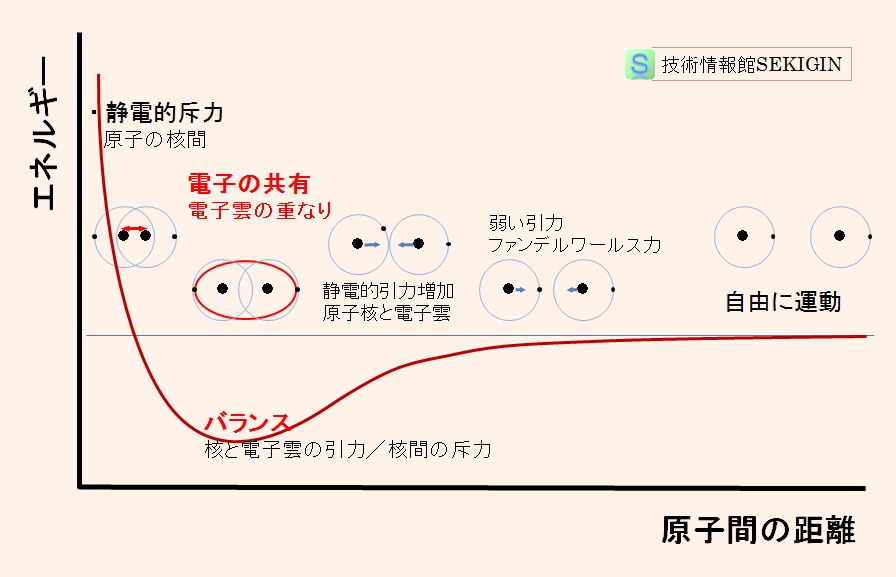
水素原子の原子間距離と相互作用(模式図)
水素原子は,【原子の構造】で解説したように,陽子 1 個と 1 S軌道( K 核)に 1 個の電子をもつ。電子雲の重なりで,それぞれの原子に帰属する電子のスピンが逆の場合には,電子が相互に引力を及ぼし合い,2 個の電子(電子対)が共通の軌道(分子軌道)を作り,2つの原子間の結合(水素分子)を安定させる。
なお,スピンが同じ場合には,パウリの排他原理( Pauli principle )により同じ電子軌道をとれないので,電子同志が反発しあい安定な軌道を形成できない。
このように,反対のスピン量子数を持つ電子 2つを共有することで結合が形成されるので,共有結合という。水素分子の電子軌道は,電子対で満たされヘリウム(希ガス類)と同じ電子状態になる。このように,共有結合による分子軌道が,希ガス類と同じ電子配置(希ガス構造などともいう)になることで化学的に安定になる。
2 種類の水素分子
電子と同じように,原子核もスピンをもつ。すなわち,水素分子の 2つの核のスピンが同方向と逆方向の場合が考えられる。
このことについては,1927年に理論的に存在が予想され,1929年に実証された。同方向のスピンをもつ水素分子をオルト水素( ortho – H2 ),逆方向のスピンをもつ水素をパラ水素( para – H2 )という。
自然界の水素は,両水素の混合物で,混合割合は温度に依存(ボルツマン分布に従う)し,液体窒素より低温( 77 K 以下)ではパラ水素が多く,それ以上の温度ではオルト水素の割合が多くなる。両者の比熱に大きな差異(オルト水素>パラ水素)があり,これを利用して分離することができる。
同様に,酸素( O2 )や塩素( Cl2 )などの等核二原子分子でも,核スピンの異なる 2 種類の分子の存在が確認されている。
ページのトップへ
基礎用語
電子軌道( electron orbital )
電子軌道は,主量子数( main quantum number ) n ,方位量子数( azimuthal quantum number ) l (エル) ,磁気量子数( magnetic quantum number ) m で指定される。
主量子数 n は,軌道の大きさとエネルギーを決定し,1, 2 , 3 , …の整数値をとる。これは,電子殻( K 殻, L 殻, M 殻, … )に対応する。
方位量子数 l は,軌道の形を決定し,0 , 1, 2 , … n-1の整数値をとる。これは,s 軌道,p 軌道,d 軌道,f 軌道,h 軌道に対応する。すなわち,K 殻 ( 主量子数 1 ) では l = 1 - 1 = 0となり,s 軌道しかとりえないが, N 殻 ( 主量子数 4 ) では l = 4 - 1 = 3 となり,s 軌道,p 軌道,d 軌道をとることができる。
磁気量子数 m は,各軌道を決定し,0 , ± 1, ± 2 , … ± l の整数値をとる。従って,s 軌道は, l = 0, m = 0 で 1 つの軌道を,p 軌道は l = 1 , m = -1 , 0 , 1 で 3 つの軌道を,d 軌道は l = 2 , m = -2 , -1 , 0 , 1 , 2 となり 5つの軌道を持つことができる。
分子軌道( molecular orbital )
単原子分子(希ガス)を除き,複数の原子で分子を構成した場合には,結合に関与した電子は,原子間距離に応じて,一つ以上の原子核と相互作用をもつ分子軌道で記述される。
熱運動・熱振動( thermal motion・thermal vibration )
熱運動とは,熱平衡の状態にある物体内で原子や分子が個々に行う微視的で無秩序な運動(ブラウン運動の原因)である。熱運動は,熱の本質をなす。
熱振動は,原子の振動のことで,分子や固体中の原子は運動エネルギーを持ち,基準となる位置を中心に振動運動をしている。結晶格子上の原子の熱振動は特に格子振動とよばれる。
ファンデルワールス力( Van der Waals force )
互いに近づいた原子,分子,及びイオン間に働き,その力は粒子間の距離の 6 乗( 7 乗とする文献も)に反比例する。従って,力の作用する距離は限られた範囲となる。
クーロン力( Coulomb force )
クーロン力は,静電力,静電気力,静電引力などともいわれる荷電粒子間に働く力。
クーロンの法則( Coulomb’s Low )
荷電粒子間に働く反発し,又は引き合う力が,それぞれの電荷の席に比例し,距離の二乗に反比例(逆二乗の法則)する。
電荷を帯びた 2つの荷電粒子間に働くクーロン力 ( F ) は,2つの粒子の電荷の大きさ ( q1 と q2 ) ,粒子間の距離 ( r ) より,次の関係から求められる。
F = k× ( q1×q2 )/r2
ここに,k は比例定数
パウリの排他原理( Pauli principle )
パウリにより提唱された原理で,排他律あるいは禁制原理などとも呼ばれる。「 2つ以上のフェルミ粒子は,同一の量子状態を占めることはできない。」と表現され,一つの原子内では,2 個以上の電子が同時にエネルギー・スピンなどの同じ状態をとることはないことを示す原理である。
ページの先頭へ