第三部:化学反応 化学平衡
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応の平衡に関して, 【化学平衡とは】, 【可逆反応と平衡定数】, 【平衡定数・活性化エネルギー・反応熱の関係】, 【濃度変化】 に項目を分けて紹介する。
化学平衡とは
広辞苑によると,平衡と化学平衡について,次のように説明している。
平衡( equilibrium )
① 天秤の両皿にのせた物体と錘との重さが相等しく,竿が水平の位置をとること,つり合いがとれること。
② いくつかの力が同時に,ある物体に作用して,その結果物体が静止状態を保つこと。力のつり合い。
③ 一般に,いくつかの物体からなる系の問題で,物質・電荷・エネルギーなどの授受が起こらない状態。
化学平衡( chemical equilibrium )
可逆反応において正反応の進行速度と逆反応の進行速度とが釣り合って,見かけ上反応が停止した状態。
ページの先頭へ
可逆反応と平衡定数
【化学反応とは】で紹介したように,化学式の表記において,不可逆反応( irreversible reaction )は,反応物と生成物を右向き矢印(→)で結び,可逆反応( reversible reaction )は,反応物と生成物を両向きの矢印( ⇆ )で結ぶのが原則である。
しかしながら,これまでの【化学反応速度】の紹介では,一方向の反応速度について説明していたため,可逆反応に対しても,説明し易さのため,右向きの矢印で結んだ化学式を用いていた。
実際の化学反応では,厳密な意味での不可逆反応はまれで,多くの反応は可逆反応である。
不可逆反応として扱われるものは,可逆反応の逆方向の反応が無視できるほどしか起こらない場合,反応生成物が直ちに他の化学反応で消費される場合,反応生成物が系外に除去される場合などで「反応が不可逆的に進行する」などと表現される。
可逆反応の反応速度
可逆反応では,右向きの正反応と,左向きの逆反応が同時に起る反応である。しかし,平衡状態に至るまでに,正反応と逆反応の反応速度は時々刻々と変化する。この現象をそれぞれの反応速度式を用いて解説する。
正反応の反応式と反応速度式
αA +βB +γC +・・・ → ν'α'A' +β'B' +γ'C' +・・・
ν = k [A]α [B]β [C]γ・・・
逆反応の反応式と速度式
ν'α'A' +β'B' +γ'C' +・・・ → αA +βB +γC +・・・
ν' = k' [A']α' [B']β' [C']γ'・・・
反応開始時
反応物質の量は,正反応では初期濃度 [A] = [A0] ,[B] = [B0] ,[C] = [C0] ,・・・であるのに対し,逆反応の反応物質は,[A'] = 0 ,[B'] = 0 , [C'] = 0 ,・・・である。
すなわち,反応開始時には,逆反応の速度 ν' = 0 となり,正反応のみが起こる。
反応初期
反応が進むことで,正反応の反応物質量の減少により反応速度νが低下するとともに,生成物量が増加する。
従って,逆反応の反応物質量の増加により反応速度ν'が増加する。
反応平衡時
反応開始後の十分に時間が経過した段階では,正反応の反応速度(ν )と逆反応の反応速度ν'が等しく(ν=ν')なる。
すなわち,反応物と生成物の濃度が見かけ上変化しない化学平衡の状態に至る。
ここで,K = k / k'と置くと,
K ={ [A']α' [B']β' [C']γ'・・・ }/ { [A]α [B]β [C]γ・・・ }=一定
が得られる。化学平衡状態での速度定数の比 K は,一定となり,これを平衡定数( equilibrium constant )という。
平衡状態での反応物と生成物の濃度比は,速度定数の比と相関があることが分かる。この関係は, 【反応速度式とは】で紹介した質量作用の法則(又は,化学平衡の法則ともいう)である。
可逆反応のエネルギー状態
単純化した可逆反応( A ⇆ B )の正反応と逆反応のエネルギー状態を模式的に示すと図のようになる。
図に示すように,正反応が発熱反応の場合には,逆反応は吸熱反応となる。従って,逆反応の活性化エネルギーは,正反応の活性化エネルギー+反応熱となる。
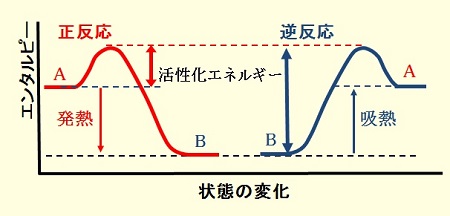
可逆反応のエネルギー状態【模式図】
ページの先頭へ
平衡定数・活性化エネルギー・反応熱の関係
【速度定数と活性化エネルギー】で紹介したように,,アレニウスの式で得られる速度定数は, 温度一定の時,1 mol 当たりの活性化エネルギーに依存する。
アレニウスの式: k = A exp ( -Ea / RT )
ここに,k :速度定数,A :頻度因子,Ea :活性化エネルギー,R :気体定数,T :熱力学的温度
正反応の速度定数と逆反応の速度定数の比である平衡定数と活性化エネルギーの関係をボルツマン因子{ exp ( -Ea / RT ) }を用いて考察してみる。
正反応の活性化エネルギーをα kJ mol-1 とし,反応熱をβ kJ mol-1 とすると,逆反応の活性化エネルギーは,γ=α+β kJ mol-1 となる。
平衡定数 K は,正反応と逆反応の速度定数の比( k / k' )で,ボルツマン因子の比と比例するので,
K ∝ exp ( -α/ RT ) / exp ( -γ/ RT ) = exp {( -α + γ ) /RT} = exp (β/RT )
となる。
すなわち,平衡定数 K は,正反応の活性化エネルギーの影響を受けず,反応熱βの大きさに影響されることが分かる。
ページの先頭へ
濃度変化
化学平衡時の反応物と生成物の濃度比は,速度定数の比の逆数に比例する。従って,反応熱の影響を大きく受ける。すなわち,反応熱の大きい化学反応は,一方の濃度が著しく大きく,見かけ上の不可逆反応と評価されることになる。
可逆反応の化学平衡に至るまでの濃度変化を,反応熱が小さい場合と大きい場合について模式的に示すと下図のようになる。
初期段階では,正反応が圧倒的に優勢のため,反応物の濃度減少が大きく,生成物の濃度増加も大きい。
その後,反応物の濃度が低下し,右向きの反応速度が低下する。一方,生成物の濃度の増加により,逆反応の速度が増加し,最終的には,濃度がある一定値で変化しなくなる。
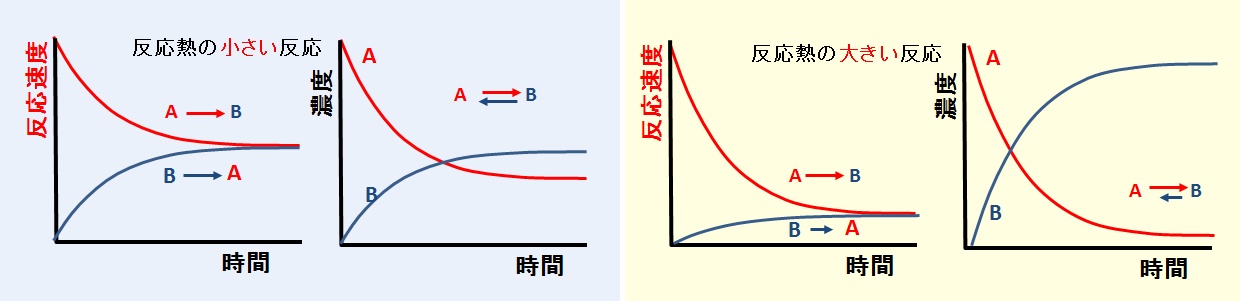
可逆反応の反応速度と濃度の変化【模式図】
ページの先頭へ